Ցելիակիա
Ցելիակիան երկարատև աուտոիմուն հիվանդություն է, որը հիմնականում ախտահարում է բարակ աղիքը[4]։ Դասական ախտանշանները ներառում են ստամքսաղիքային խնդիրներ, ինչպիսիք են քրոնիկական փորլուծությունը, փորափքանք, ներծծման խանգարումները, ախորժակի կորուստը, երեխաների շրջանում նորմալ աճի խանգարումը[2]։ Այն հաճախ սկսվում է վեց ամսականից մինչև երկու տարեկանը[2]։ Ոչ դասական ախտանշանները ավելի հաճախակի են, հատկապես երկու տարեկանից մեծ անձանց մոտ[13][15][16]։ Կարող են լինել ստամոքսաղիքային ախտանշանների բացակայություն կամ թույլ արտահայտվածություն, կամ մարմնի ցանկացած մաս ախտահարող բազմաթիվ ախտանշաններ, կամ ակնհայտ ախտանշանների բացակայություն[2]։ Ցելիակիան առաջին անգամ նկարագված է եղել մանկական տարիքում[11][13], սակայն այն կարող է զարգանալ ցանկացած տարիքում[2][13]։ Այն ասոցացված է այլ աուտոիմուն հիվանդությունների հետ, ինչպիսիք են շաքարային դիաբետ տիպ 1 և թիրեոիդիտ[11]։
| Ցելիակիա | |
|---|---|
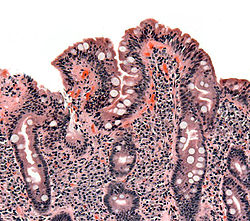 Բարակ աղու բիոպսիա, ցուցադրված է ցելիակիայի ախտահարումը աղիքային թավիկների հետաճով, կրիպտաների գերաճով և լիմֆոցիտային ինֆիլտրացիայով կրիպտաների շուրջ։ | |
| Տեսակ | հիվանդության կարգ և ախտանիշ կամ նշան |
| Պատճառ | Գլյուտենի հանդեպ պատասխան ռեակցիա[1] |
| Հիվանդության ախտանշաններ | բացակայում են կամ ոչ սպեցիֆիկ ախտանշաններ, փորափքանք, փորլուծություն, փորկապություն, ներծծման խանգարումներ, քաշի կորուստ, հերպետիկ մաշկաբորբ[2][3] |
| Բժշկական մասնագիտություն | աղեստամոքսաբանություն |
| Հոմանիշներ | Ցելիակիային սփրու, ոչ տրոպիկական սփրու, էնդեմիկ սփրու, գլյուտենային էնտերոպաթիա |
| Ախտորոշում | Ընտանեկան անամնեզ, արյան հակամարմինների թեստ, աղիքային բիոպսիա, գենետիկական հետազտություն, դրական պատասխան գլյուտենի բացառմանը[4][5] |
| Տարբերակիչ ախտորոշում | Աղուբորբոքային հիվանդություն, աղիքային մակաբույծներ, գրգռված աղու համախտանիշ[6] |
| Բուժում | Առանց գլյուտենի դիետա[7] |
| Բարդություններ | Երկաթ դեֆիցիտային սակավարյունություն, օստեոպորոզ, անպտղություն, քաղցկեղներ, նյարդաբանական խանգարումներ, այլ աուտոիմուն հիվանդություններ[8][9][10][11][12] |
| Սկիզբը | Ցանկացած տարիք[2][13] |
| Տևողություն | Ամբողջ կյանքի ընթացքում[11] |
| Հանդիպման հաճախականություն | ~1-ը 135-ից[14] |
Ցելիակիան հիվանդություն է, որն առաջանում է ի պատասխան գլուտենի՝ տարբեր սպիտակուցների խմբի, որոնք պարունակում են ցորենի և այլ հացահատիկային տեսակների մեջ, օրինակ գարի և տարեկան[1][17][18]։ Սովորաբար թույլատրվում է չափավոր քանակությամբ վարսակ, որը զերծ է այլ գլյուտեն պարունակող հացահատիկազգիներից[17][19]։ Խնդիրների ի հայտ գալը կարող է կախված լինել վարսակի տարատեսակից[17][20]։ Հիվանդությունն առաջանում է այն մարդկանց մոտ, ովքեր ունեն ժառանգական նախատրամադրվածություն[4]։ Գլյուտենի հետ հանդիպումից իմունային պատասխանը կարող է հանգեցնել տարբեր հակամարմինների սինթեզի, որոնք կարող են ազդեցություն ունենալ տարբեր օրգանների վրա[9][21]։ Բարակ աղիքում այն առաջացնում է բորբոքային պրոցես և կարող է հանգեցնել բարակ աղիքը ծածկող թավիկների կարճեցման (թավիկների ապաճ)[4][5]։ Սա ազդում է սննդանյութերի ներծծման վրա, ինչն էլ հաճախ հանգեցնում է սակավարյունության[4][18]։
Ախտորոշումը, որպես կանոն, դրվում է համակցելով հակամարմինների առկայությունը արյան քննությամբ և աղիքի բիոպսիայի պատասխանները, որոնք կատարվում են սպեցիֆիկ գենետիկական թեստավորումով[4]։ Ախտորոշումը միշտ չէ, որ հեշտ է դրվում[22]։ Հաճախ արյան մեջ աուտոհակամարմինները բացասական են[23][24], իսկ շատ մարդկանց մոտ աղիքային փոփոխությունները աննշան են՝ պահպանված աղիքային թավիկներով[25]։ Մարդկանց մոտ կարող են լինել լուրջ ախտանշաններ, և նրանք կարող են շատ տարիներ շարունակ հետազոտվել, մինչ հստակ ախտորոշում կդրվի[26][27]։ Գնալով ավելի հաճախակի են դառնում դեպքերը, երբ ախտորոշումը դրվում է անախտանիշ մարդկանց՝ սքրինինգային հետազոտքության արդյունքում[28]։ Ինչևէ, սքրինինգային հետազոտության օգտակարությունը հաստատող փաստացի ապացույցներ չկան[29]։ Չնայած հիվանդությունը առաջանում է գլյուտենի հանդեպ մշտական անհանդուրժողականության հետևանքով[4], այն տարբերվում է ցորենի անդեպ ալերգիկ պատասխանից, որը հանդիպում է շատ ավելի հազվադեպ[30]։
Միակ հայտնի արդյունաավետ բուժումը ամբողջ կյանքի ընթացքում առանցգլյուտենային դիետայի խիստ պահպանումն է, որը հանգեցնում է բարակ աղու լորձաթաղանթի վերականգնման, բարելավում է ախտանշանները և իջեցնում բարդությունների զարգացման վտանգը շատ մարդկանց մոտ[7]։ Բուժման բացակայության դեպքում այն կարող է հանգեցնել քաղցկեղային հիվանդությունների, ինչպիսիք են աղիքային լիմֆոման, և մի փոքր վաղ մահացության ռիսկի մեծացման[8]։ Երկրի տարբեր տարածաշրջաննեում ցուցանիշները տատանվում են՝ 1:300-ից մինչև 1:40 հաճախականությամբ, միջինում կազմելով 1:100-1:170[14] : Ըստ դիտարկումների 80% դեպքերում ախտորոշումը պարզված չի լինում, որպես կանոն, ստամոքսաղիքային ախտանշանների բացակայության կամ տույլ արտահայտված լինելու և ախտանշանների ու ախտորոշիչ չաձանիշների անբավարար իմացության պատճառով[10][26][31]։ Ցելիակիան ավելի հաճախ հանդիպում է կանանց քան տղամարդկանց մոտ[32]։
Ախտանշաններ
խմբագրելՉբուժված ցելիակիայի դասական ախտանշաններն են անգույն, ոչ պինդ և ճարպոտ դեֆեկացիա (ստեատորեա), քաշի կորուստ կամ քաշ հավաքելու անկարողություն։ Այլ ընդհանուր ախտանշաններըկարող են թույլ նշմարելի լինել կամ հանդիպել հիմնականում աղիքից տարբերվող օրգաններում[33]։ Ինչպես նաև հնարավոր է ունենալ ցելիակիա առանց որևէ դասական ախտանշանի առհասարակ[18]։ Ապացուցված է, որ երեխաների մոտ այն կազմում է 43%-ից ոչ պակաս[34]։ Բացի այդ, մեղմ դրսևորումներով շատ մեծահասակներ կարող են գանգատվել միայն թուլությունից կամ սակավարյունությունից[28]։ Շատ չախտորոշված մարդիկ, որոնք իրենց համարում են անախտանիշ, իրականում են ունեն ախտանշաններ, բայց ընտելացել են որոշակի շեղումներով քրոնիկ առողջական վիճակին։ և իսկապես, առանց գլյուտենային սննդակարգին անցնելուց հետո և չբուժված հիվանդության հաջորդող բարելավումից հետո պարզ է դառնում, որ այդ հիվանդները ռետրոսպեկտիվ կարող են վերհիշել և ճանաչել այն ախտանշանները, որոնք իրենք սխալմամբ անտեսում էին[10][27][31]։
Ստամոքսաղիքային
խմբագրելՑելիակիային հիվանդությանը բնորոշ է քրոնիկ փորլուծությունը, երբեմն անգույն, մեծ քանակությամբ, և ոչ նորմալ վատ հոտով։ կարող է առկա լինել ցավ որովայնում, կծկանքներ, որովայնի ուռածություն փորափքանքով (աղիներում ֆերմենտատիվ ռեակցիաներում գազի կուտակման հետևանքով) և բերանի խոռոչում խոցեր[35]։ Քանզի աղիները գնալով ավելի են վնասվում, ապա լակտոզային անտանելիությունը կարող է ավելի զարգանալ[18]։ Հաճախ ախտանշանները վերագրվում են գրգռված աղու համախտանիշին (ԳԱՀ), միայն հետո ճանաչվում է որպես ցելիակիա։ ԳԱՀ ախտանշաններով մարդկանց պոպուլյացիայում ցելիակիա ախտորոշվում է 3.3% դեպքերում, կամ չորս անգամ ավելի հաճախ քան ընդհանուր դեպքերում[36]։ Նրանց սքրինինգի ենթարկելը խորհորդ է տրվում առողջապահության ր կլինիկական կատարելության ազգային ինստիտուտի (NICE), Գաստրոէնտերոլոգների բրիտանական ասոցիացիայի և գաստրոէնտերոլոգիայի ամերիկյն քոլեջի կողմից, բայց ոչ հստակ դիրքորոշում կա Հյուսիսային Ամերիկայի կողմից[36][37]։
Ցելիակիան հանգեցնում է ինչպես ադենոկարցինոմաների բարձր ռիսկի, այնպես էլ բարակ աղու լիմֆոմայի (էնտերոպաթիա՝ Т-բջջային լիմֆոմայի հետ ասոցացված կամ այլ ոչ հոջկինյան լիմֆոմաների)[38]։ Այդ ռիսկը բարձր է նաև առաջին կարգի արյունակիցների մոտ, ինչպես քույր ու եղբոր, ծնողների և երեխաների։ Առանց գլյուտենային սննդակարգը արդյոք բերում է ռիսկը սկզբնական մակարդակին, պարզ չէ[39]։ Երկարատև և չբուժված հիվանդությունը կարող է հանգեցնել այլ բարդությունների, ինպես օրինակ աղիճ աղու խոցային բորբոքումը և սպիական փոփոխությունների հետևնքով լուսանցքի նեղացումը[40]։
Ներծծման խանգարումներ
խմբագրելԱղիքային փոփոխությունները դժվարացնում են սննդանյութերի, հանքային տարրերի և ճարպալույծ վիտամինների (A, D, E, K) ներծծումը[18][41]։
- Ածխաջրեր և ճարպեր ներծծելու անկարողությունը կարող է հանգեցնել քաշի կորստի (աճի խանգարման երեխաների շրջանում), հոգնածության զգացողության կամ էներգիայի բացակայության։
- Անեմիան կարող է զարգանալ մի քանի եղանակով՝ երկաթի թերի ներծծումը կարող է առաջացնել երկաթ դեֆիցիտային սակավարյունության, ֆոլաթթվի և վիտամին B12-ի ոչ լիարժեք ներծծումը կհանգեցնի մեգալոբլաստիկ սակավարյունության։
- Կալցիումի և վիտամին D-ի թերներծծումը և կոմպենսատոր երկրորդային հիպերպարաթիրեոիդիզմը կարող են առաջացնել օստեոպենիա (ոսկրերում հանքային նյւթերի պարունակության նվազում) կամ օստեոպորոզ (ոսկրերի փխրունություն, թուլացում և կոտրվածքների ռիսկ)
- Սելենի թերներծծումը ցելիակիայի դեպքում, զուգակցված սելենի ցածր քանակությամբ առանց գլյուտենային սննդամթերքում, բերում է սելենի անբավարարության ռիսկի[42]։
- Պղնձի և ցինկի անբավարարությունը նույնպես ասոցացված են ցելիակիայի հետ[42]։
- Հիվանդների փոքր հատվածը ունի կոագուլյացիոն անկանոնություններ վիտամին K-ի անբավարարության պատճառով, և հակված են չկարգավորված արյունահոսությունների ռիսկի։
Այլ
խմբագրելՑելիակիան կապված է շատ այլ վիճակների հոտ։ Շատ դեպքերում անհասկանալի է գլյուտեն հրահրված աղիքային հիվանդությունը պատճառային գործոն է, թե այս վիճակները արտացոլում են ընդհանուր նախատրամադրվածություն։
- IgA անբավարարությունը առկա է ցելիակիայով հիվանդ անձանց 2.3%-ի մոտ, և ինքն իրենով հենց տասնակի մեծացնում է ցելիակիայի զարգացման ռիսկը։ Այս վիճակի այլ առանձնահատկություններ են համարվում վարակների և աուտոիմուն հիվանդությունների զարգացման մեծացած ռիսկը[43]։
- Հերպետիկ դերմատիտը, մածկի սաստիկ քոր առաջացնող վիճակ է, մաշկում տրանսգլյուտամինազա ֆերմենտի առկայության հետևանք է, բարակ աղում առաջացնում է ցելիակիային բնորոշ փոփոխություններ, և կարող է պատասխան տալ սննդակարգից գլյուտենի բացառմանը, անգամ եթե բացակայում են աղեստամոքսային ախտանշանները[44][45]։
- Աճի խանգարումը և/կամ սեռահասունության հապաղումը ուշ մանկական տարիքում կարող է լինել առանց ակնհայտ աղիքային փոփոխությունների և խիստ թեսնուցման երևույթների։ Աճի դանդաղման գնահատումը հաճախ ներառում է ցելիակիայի սքրինինգ[18]։
- Ցելիակիայով հիվանդների մոտ կարող են դիտվել հղիության բարդություններ, որպես հղիությանը զուգակցող հիվանդություն, որը կարող է էական խնդիրներ առաջացնել, ներառելով վիժումը, ներարգանդային աճի դանդաղումը, ցածր քաշը և վաղաժամ ծննդաբերությունը[46]։
- Հըպոսպլենիզմ (թոքր և թերակտիվ փայծաղ)[47] occurs in about a third of cases and may predispose to infection given the role of the spleen in protecting against bacteria.[18]:
- Կարող են նկատվել լյարդի ֆունկցիոնալ թեստերի նորմայից շեղումներ (պատահականորեն հայտնաբերվում է արյան քննությամբ)[18]։
Ցելիակիան փոխկապակցված է մի քանի այլ հիվանդագին վիճակների հետ, որոնց մեծ մասը աուտոիմուն ծագման է՝ շաքարային դիաբետ տիպ 1, հիպոթիրեոզ, առաջնային բիլիար խոլանգիտ, միկրոսկոպիկ աղեխիթ, գլյուտենային ատաքսիա, պսորիազ, վիտիլիգո, աուտոիմուն հեպատիտ, հերպետիկ դերմատիտ, առաջնային սկլերոզացնող խոլանգիտ և այլն[9]։
Պատճառ
խմբագրելՑելիակիայի պատճառը պատասխան ռեակցիան է գլիադինի և գլյուտենինի հանդեպ (գլյուտենային սպիտակուցներ)[48], որոնք գոյություն ունեն ցորենի հատիկներում, և համանման սպիտակուցներ, որոնք պարունակվում են Տրիտիցե ցեղատեսակի բերքում (որը ներառում է գարին և տարեկանը)[18] և Ավենի ցեղատեսակում (վարսակաձավար)[49]։ Ցորենի տարատեսակները (օրինակ՝ դուռումը և կամուտը) և ցորենի հիբրիդները (օրինակ՝ տրիտիկալե) նույնպես կարող են առաջացնել ցելիակիայի ախտանշաններ[49][50]։
Ցելիակիայով հիվանդ մարդկանց փոքր հատվածի մոտ կարող է դիտվել ռեակցիա վարսակի հանդեպ[18]։ Վարսակի թոքսիկությունը կախված է վարսակի կոնկրետ տեսակից՝ պրոլամին գեներով, սպիտակուցների ամինաթթուների հաջորդականությունով, թունավոր պրոլամինների հանդեպ իմուն պատասխանով պայմանավորված, որոնք ամեն տեսակի համար տարբեր են[20][51]։ Վարսակի տեսակները նաև խաչասերված են այլ հացազգիների հետ, այդ իսկ պատչառով պարունակում են գլյուտեն[20][51][52]։ «Մաքուր վարսակ» կոչվում է վարսակի այն տեսակը, որը չի պարունակում այլ հատիկային կուլտուրաներ, հետևապես՝ գլյուտեն[20]։ Մաքուր վարսակի երկարատև օգտագործման հետևանքները դեռ վերջնապես պարզված չեն[53] և անհրաժեշտ են հետագա հետազոտություններ, որոնք կբացահայտեն կոնկրետ տեսակներ և թույլ կտան դրանք ներառել առանց գլյուտենային սննդակարգում[52]։ Ցելիակիայով հիվանդ այն մարդիկ, ովքեր օգտագործում են իրենց սննդակարգում վարսակ, ամբողջ կյանքի ընթացքում պետք է ենթարկվեն ավելի խիստ բժշկական հսկողության, հնարավոր է ներառելով նաև պարբերական աղիքային բիոպսիաներ[53]։
Այլ հացազգիներ
խմբագրելԱյլ հացահատիկները, ինչպիսիք են եգիպտացորենը, կորեկը, մաղադանոսը, տեֆը, բրինձը և վայրի բրինձը անվտանգ են ցելիակիայով հիվանդների օգտագործման համար, ինչպես նաև ոչ հացահատիկայինները, օրինակ՝ ամարանան, քվինոան և հնդկաձավարը[50][54]։ Ոչ հացահատիկային ածխաջրերով հարուստ սննդամթերքը, ինչպես կարտոֆիլը և բանանը չեն պարունակում գլյուտեն և չեն կարող խթան հանդիսանալ հիվանդության զարգացման համար[50]։
Ռիսկը մեծացնողներ
խմբագրելԳոյություն ունեն տարատեսակ տեսություններ, թե ինչի հետևանքով է գենետիկորեն ցելիակիային նախատրամադրվածությամբ անձի մոտ զարգանում հիվանդությունը։ Հիմնական տեսությունները ներառում են վիրաբուշական միջամտությունը, հղիությունը, վարակները և էմոցիոնալ սթրեսը[55]։
Երեխայի վաղ տարքում գլյուտենի օգտագործումը ըստ երևույթի չի մեծացնում ցելիակիայի զարգացման ռիսկը, բայց ավելի ուշ, վեց ամսականից հետո կարող է մեծացնել[56][57]։ Դեռևս անորոշ է, նվազեցնում է արդյոք կրծքով կերակրումը հիվանդության զարգացման ռիսկը թե ոչ։ Կրծքով կերակրման երկարաձգումը մինչը ռացիոնում գլյուտեն պարւնակող մթերքների ավելացումը 50%-ով նվազեցնում է ռիսկը մանկական հասակում. ազդեցություն ունի մեծ տաիքում թե ոչ, պարզ չէ[58]։ Այս գործոնները կարող են միայն ազդեցություն ունենալ հիվանդության մեկնարկի վրա[59]։
Ախտաֆիզիոլոգիա
խմբագրելՑելիակիան բազմագործոնային իվանդություն է, քանի որ մեկից ավելի գործոններ են կարող են առաջացնել հիվանդությունը, և հիվանդության դրսևորման համար անհրաժեշտ է մեկից ավելի գործոնների առկայություն։
Գրեթե բոլոր (95%) ցելիակիայով հիվանդները ունեն HLA-DQ2 ալելը կամ (ավելի հազվադեպ) HLA-DQ8 ալելը[28][60]։ Ինչևէ, առողջ մարդկանց 20–30%-ը նույնպես ժառանգել են այս ալելներից որևիցե մեկը[61]։ Սա խոսում է այն մասին, որ ցելիակիայի զարգացման ահամար անհրաժեշտ են լրացուցիչ գործոններ. այսինքն նախատրամադրող ռիսկային HLA ալելի առկայությունը պարտադիր է, բայց բավական չէ հիվանդության զարգացման համար։ Ավելին՝ ցելիակիայով հիվանդների 5%-ը չունեն այս տիպիկ ալելներից (HLA-DQ2 կամ HLA-DQ8) որևէ մեկը[28]։
Ժառանգականություն
խմբագրելՑելիակիայով հիվանդների ճնշող մեծամասնությունը ունի HLA-DQ սպիտակուցի երկու տեսակներից մեկը[61]։ HLA-DQ-ն հանդիսանում է MHC II դասի հակածին ներկայացնող ընկալիչային համակարգի մի մաս (որը կոչվում է նաև մարդու լեյկոցիտային հակածին) և առանձնացնում է բջիջները սեփական և ոչ սեփականնների իմուն համակարգին ներկայացնելու նպատակով։ HLA-DQ սպիտակուցի երկու ենթատեսակները կոդավորված են HLA-DQA1 և HLA-DQB1 գեներով, և տեղակայված են 6-րդ քրոմոսոմի կարճ թևիկին։
HLA-DQ ունի յոթ տեսակ (DQ2 և DQ4–DQ9). Ցելիակիայով հիվանդների շուրջ 95%-ը ունեն DQ2 կամ DQ8 իզոձևերը, որը ժառանգված է տվյալ ընտանիքում։ Այս գեները մեծացնում են ցելիակիայի զարգացմնա ռիսկը, այն պատճառով, որ այս գեներով ձևավորված ընկալիչները ավելի ամուր են կապվում գլիադին պեպտիդին քան հակածին ներկայացնող ընկալիչների այլ ձևերը։ Հետևաբար, ընկալիչների այս ձևերը ավելի հակված են ակտիվացնելու T-լիմֆոցիտները և հրահրելու աուտոիմուն գործընթացի կատիվացումը[28]։
Ցելիակիայով հիվանդ մարդկանց մեծ մասը ունեն երկգենային HLA-DQ2 հապլոտիպ, որը կոչվում է DQ2.5 հապլոտիպ։ Այս հապլոտիպը բաղկացած է երկու հարակից գենային ալելներից DQA1*0501 և DQB1*0201, որոնք կոդավորում են որկու ենթամիավորներ՝ DQ α5 and DQ β2: Շատերի մոտ այս DQ2.5 իզոչևը կոդավորված է ծնողներից ժառանգած երկու 6-րդ քրոմոսոմներից մեկով (DQ2.5cis): Ցելիակիայով հիվանդների մեծ մասը ժառանգում է DQ2.5 հապլոտիպից միայն մեկը, մինչդեռ ոմանք ժառանգում են միաժամանակ երկու ծնողներից. վերջիններս ցելիակիայի զարգացման ավելի մեծ ռիսկի և դրանով պայմանավորված բարդությունների են հակված[62]։
Որոշ անհատներ ժառանգում են DQ2.5- ը մի ծնողից, իսկ հապլոտիպի լրացուցիչ մասը (կամ DQB1 * 02 կամ DQA1 * 05) մյուս ծնողից` ինչն ավելացնում է ռիսկը։ Ավելի հազվադեպ, ոմանք ժառանգում են DQA1 * 05 ալելը մեկ ծնողից և DQB1 * 02 մյուս ծնողից (DQ2.5տրանս) (կոչվում է տրանս-հապլոտիպային ասոցիացիա), և այդ անձինք նմանատիպ ռիսկի խմբում են ցելիակիայի զարգացման, ինչպես նրանք, ովքեր 6-րդ քրոմոսոմի մեկ DQ2.5 կրող են, բայց այս դեպքում հիվանդությունը հիվանդությունը այլևս չի համարվում ընտանեկան։ Եվրոպացիների ցելիակիայով հիվանդների 6%-ի մոտ չկա DQ2.5 (ցիս կամ տրանս) կամ DQ8 (կոդավորված է հապլոտիպ DQA1 * 03: DQB1 * 0302), 4%-ը ունեն DQ2.2 իզոձև, իսկ մնացած 2%-ի մոտ բացակայում է DQ2 կամ DQ8[63]:
Այս գեների հաճախականությունը աշխարհագրականորեն տարբերվում է։ DQ2.5-ը բարձր հաճախականություն ունի Հյուսիսային և Արևմտյան Եվրոպայի ժողովուրդների շրջանում (Բասկերի հողեր և Իռլանդիա[64] առավելագույն հաճախություններով), Աֆրիկական շրջաններում և Հնդկաստանում[65], բայց այն տարածված չի խաղաղօվկիանոսյան սահմանի արևմտյան մասերում։ DQ8-ն ունի ավելի լայն գլոբալ բաշխում, քան DQ2.5-ը և հատկապես տարածված է Հարավային և Կենտրոնական Ամերիկայում։ Հնդկացիների որոշ ցեղերի ներկայացուցիչների մինչև 90%-ը կրում է DQ8 և այդպիսով կարող է դրսևորվել ցելիակիայի ֆենոտիպ[66]։
Այլ գենետիկ գործոնների մասին բազմիցս նշվել է ցելյակիայի ժամանակ, այնուամենայնիվ, հիվանդության զարգացման համար փոփոխական աշխարհագրական ներգրավվածություն ունի։ Միայն HLA-DQ լոկուսն է հաստատուն և միանշանակ համաշխարհային պոպուլյացիայի համար[67]։ Հայտնաբերված լոկուսներից շատերը դիտվում են այլ աուտոիմունային հիվանդությունների դեպքում։ Մեկ լոկուս՝ LPP կամ լիպոմա-ասոցացված գործընկեր գենը մասնակցում է արտաբջջային մատրիքսի ադհեզիվությանը բջջի մակերևույթին, իսկ փոքր տարբերակը (SNP = rs1464510) մեծացնում է հիվանդության ռիսկը մոտավորապես 30%-ով։ Այս գենը խստորեն կապված է ցելիակիա հիվանդության հետ (հ < 10−39), որոնք վերցված են եղել Եվրոպայի և ԱՄՆ-ի մեծամաշտաբ տարածքներիցից[67]։
Ժամանակակից պոպուլյացիայում ցելիակիայի գենոտիպերի տարածվածությունը ամբողջությամբ հետազոտված չէ։ Հաշվի առնելով հիվանդության բնութագրերը և դրա ակնհայտ ժառանգական կապը, բնականաբար, ակնկալելի կլիներ, եթե տեղի ունենար բացասական ընտրություն և այդ գենոտիպերը բացակայեին այն հասարակություններում, որտեղ երկարատև զբաղվում են գյուղատնտեսությամբ, (պետք է համեմատել նմանատիպ պայմանների հետ, երբ լակտոզայի անհանդուրժողականությունը, որը նշանակալի բացասական ընտրության հետևանքով, ունենալով ~100% տարածվածություն, եվրոպական որոշ երկրներում իրենց նախնիներից նոր սերունդներին անցել է 5% -ից պակաս։ Այս տեսակետն առաջին անգամ առաջարկել է Սիմոնսը (1981)[68]։ Մինչ այժմ, սակայն, ակնհայտ է, որ դա այդպես չէ. ընդհակառակը, գենոտիպերում կա ցելիակիայի դրական ընտրության ապացույց։ Կասկածվում է, որ նրանցից որոշները գուցե օգտակար են եղել՝ պաշտպանելով մանրէային վարակներից[69][70]։
Պրոլամիններ
խմբագրելՍննդային սպիտակուցների մեծ մասը, որոնք պատասխանատու են ցելիակիայի ժամանակ իմունային ռեակցիայի համար, հանդիսանում են պրոլամիններ։ Սրանք պահեստային սպիտակուցներ են, որոնք հարուստ են պրոլինով (պրոլ-) և գլուտամինով (-ամին), լուծվում են սպիրտում և դիմացկուն են աղիքային պրոտեազների և պեպտիդազների հանդեպ[28][71]։ Պրոլամինները հայտնաբերվում են տարատեսակ հացահատիկներում, որոնք ունեն տարբեր, բայց համանման պրոլամիններ՝ ցորեն (գլիադին), գարի (հորդեին), տարեկան (սեկալին) և վարսակ (ավենին)[49]։ α-գլիադինի մի հատվածը խթանում է աղիների թաղանթային բջիջները, էնտերոցիտները՝ թույլ տալով ավելի մեծ մոլեկուլների անցումը հերմետիկ հատվածով։ Ամուր կապերի խանգարումը թույլ է տալիս երեք ամինաթթուներից ավելի մեծ պեպտիդների անցումը աղիքային պատնեշով[72]։
Թաղանթի վնասումը թույլ է տալիս գլիադինի ներթափանցումը, ինչն առաջացնում է իմունային պատասխանի երկու փուլեր՝ բնածին իմունային պատասխան և ձեռքերովի (T-հելփեր միջնորդավորված)։ α-գլիադինի պրոտեազ-կայուն պեպտիդը պարունակում է հատված, որը խթանում է լիմֆոցիտներին և ինտերլեյկին-15 ձերբազատումը։ Գլիադինի հանդեպ այս բնածին պատասխանը ազդանշանում է իմուն համակարգին, որը ներգրավում է բորբոքային բջիջերը և բորբոքային միջնորդանյութերը[28]։ Ամենաուժեղ և ադապտիվ պատասխանը տեղի է ունենում 33 ամինաթթուներ պարունակող գլիադինի հատվածի հանդեպ[28]։
33մերային պեպտիդի հանդեպ իմուն պատասխան տեղի է ունենում գրեթե բոլոր ցելիակիայով հիվանդների շրջանույ, ովքեր գենոտիպում ունեն DQ2 իզոձևը։ Այս պեպտիդե, վնասվելով աղիքային տրանսգլուտամինազայի կողմից, ձեռք է բերում T-բջջային էպիտոպների վերածածկման բարձր խտություն։ Սա մեծացնում է պեպտիդի DQ2 իզոձևի հետ կապման և կապված մնալու հավանականությունը T-բջիջբների ճանաչման ժամանակ[73]։ Ցորենում պարունակվող գլիադինը հանդիսանում է ամենահասկանալի և տարածված պեպտիդը, բայց նաև այլ պրոլամիններ՝ հորդեին (գարի), սեկալին (տարեկան) և ավենին (վարսակ) կարող են առաջացնել ցելիակիա[28][49][74]։ Ավենինի տոքսիկությունը ցելիակիայով տառապող մարդկանց դեպքում կախված է վասակի տեսակից, քանզի տարբեր են պրոլամինների գեները, սպիտակուցների ամինաթթվային հաջորդականությունները, և տոքսիկ պրոլամինների իմունոռեակտիվությունը, ինչը փոփոխվում է կախված վարսակի տեսակից[20]։
Հյուսվածքային տրանսգլյուտամինազա
խմբագրելՀյուսվածքային տրանգլյուտամինազայի հանդեպ հակա-տրանսգլյուտամինազային հակամարմինները հայտնաբերվում են դասական ախտանշաններով և թավիկային լիարժեք ատրոֆիայով հիվանդների մեծամասնության արյան մեջ, մասնակի թավիկային ատրոֆիայով դեպքերի 70%-ի մոտ և, դասական ախտանշաններով և աննշան լորձաթաղանթի վնասումներով դեպքերի 30%-ի մոտ[23]։ Հյուսվածքային տրանսգլյուտամինազան ձևափոխում է գլյուտենային պեպտիդը այնպես, որ այն կարող է ավելի էֆեկտիվ խթանել իմունային համակարգը[28]։ Այս պեպտիդները կարող են ձևափոխվել երկու եղանակով՝ դեամինացման և տրանսամինացման[75]։
Դեզամինացումը ռեակցիա է, որի ժամանակ գլյուտամինի կողմնային շղթայի էպսիլոն-ամինախմբի հեռացման միջոցով ձևավորվում է գլյուտամինաթթվի մնացորդ։ Տրանսամինացումը, որն եռակի ավելի հաճախ է պատահում, գլիադինային պեպտիդից գլուտամինի մնացորդի խաչաձև միացումն է հյուսվածքային տրանսգլուտամինազայի լիզինի մնացորդին, որը կատալիզում է տրանսգլուտամինազան։ Միացումը կարող է իրականանալ ինչպես ֆերմենտի ակտիվ կենտրոնում, այնպես էլ դրանից դուրս։ Վերջինիս դեպքում գլիադինի և հյուսվածքային տրանսգլուտամինազայի միջև առաջանում է կովալենտ կոմպլեքս[76]։ Սա հանգեցնում է նոր էպիտոպների ձևավորման, որոնք էլ, ինչպես ենթադրվում է, գործարկում են առաջնային իմուն պատասխան, որի հետևանքով ձևավորվում են հյուսվածքային տրանսգլուտամինազայի հանդեպ աուտոհակամարմիններ[77][78][79]։
Ցելիակիայի կասկածով հիվանդների պահպանված բիոպսիայի արդյունքները ցույց տվեցին, որ աուտոհակամարմինների կուտակումներ սուբկլինիկական ընթացքով հիվանդների մոտ հայտնաբերվում են ավելի վաղ քան դրսևորվում են կլինիկական ախտանիշներ։ Այս կուտակումները հայտնաբերվում են նաև այլ աուտոիմուն հիվանդություններ, սակավարյունություն և թերսնուցում ունեցող մարդկանց մոտ ավելի մեծ հաճախականությամբ քան նորմալ պոպուլյացիայում[80]։ Հակամարմինների էնդոմիզիալ բաղկացուցիչները (EMA) հյուսվածքային տրանսգլուտամինազայի հանդեպ ուղղված են բջջի մակերևութային տրանսգլուտամինազային, և այս հակամարմինները դեռևս կիրառվում են ցելիակիա ախտորոշումը հաստատելու նպատակով։ Այնուամենայնիվ, 2006 թ. ուսումնասիրությունները ցույց տվեցին, որ EMA-բացասական ցելիակիայով հիվանդ մարդիկ որպես կանոն մեծահասակ տղամարդիկ են ավելի խիստ արտահայտված որովայնային ախտանշաններով և «ատիպիկ» ախտանշանների ավելի ցածր հաճախականությամբ, ներառյալ աուտոիմուն հիվանդությունները[81]։ Այս աշխատության մեջ հյուսվածքային տրանսգլուտամինազայի հանդեպ աուտոհակամարմինների կուտակումները չեն առընչվում թավիկների վնասման աստիճանի հետ։ Այս արդյունքները համադրելով վերջին հետազոտության հետ, որտեղ ապացուցվում է գլիադինի բնածին պատասխան առաջացնելու հնարավորությունը[82], թույլ են տալիս ենթադրել, որ գլիադինը ավելի շատ պատասխանատու է ցելիակիայի առաջնային դրսևորումների համար, մինչդեռ հյուսվածքային տրանսգլուտամինազան ավելի որոշիչ գործոն է երկրորդային բարդությունների դեպքում, ինչպիսիք են ալերգիկ պատասխանը և երկրորդային աուտոիմուն հիվանդությունները։ Ցելիակիայով հիվանդների մեծ տոկոսի մոտ, հակահյուսվածքային տրանսգլուտամինազայի հանդեպ հակամարմինները նաև ճանաչում են Ռոտավիրուսային սպիտակուցը, որը կոչվում է VP7: Այս հակամարմինները խթանում են մոնոցիտների պրոլիֆերացիան, և ռոտավիրուսը կարող է բացատրել իմունային բջիջների ակտիվացման կասկադի որոշ վաղ փուլեր[83]։
Իսկապես, ռոտավիրուսի աղիքային վնասման վաղ հետազոտությունները ցույց են տվել, որ այն կարող է առաջացնել թավիկների ապաճ[84]։ Սա թույլ է տալիս ենթադրել՝ վիրուսային պրոտեինները կարող են դերակատարում ունենալ թավիկների առաջնային հարթեցման մեջ և խթանել հակա-VP7 ինքնակարգավորվող արտադրություն։ VP7 հանդեպ հակամարմինները նույնպես կարող են դանդաղեցնել վերականգնման գործընթացը մինչ գլիադին-միջնորդավորված հՏԳ ներկայացումը կհանգեցնի խաչաձև-ռեգուլացվող հակամարմինների երկրորդային աղբյուրի։
Կան նաև այլ աղիքային խանգարումներ որոնց դեպքում բիոպսիան կարող է ցույց տալ նմանատիպ պատկեր ինչպես ցելիակիայի դեպքում, որոնց թվում է նաև Կանդիդայի ախտահարումները[85]։
Թավիկների ատրոֆիա և թերսնուցում
խմբագրելT-բջջային միջնորդավորված բորբոքային պրոցեսը հարուցում է բարակ աղու լորձաթաղանթի կառուցվածքային և ֆունկցիոնալ փոփոխությունների և խանգարում է բնականոն ներծծման գործընթացը, քանզի այն խանգարում է սննդանյութերի, հանքային նյութերի և ճարպալույծ վիտամինների՝ A, D, E, K, ներծծման հնարավորությունը։ Աղիքային ներծծող մակերեսի փոքրացման և լակտազայի իջած արտադրության հետևանքով կարող է զարգանալ լակտոզային անտանելիություն, որը սովորաբար անցնում է բուժումից հետո։
Առաժարկվել են նաևայս հյուսվածքի վնասման այլընտրանքային մեխանիզմներ, որոնք ենթադրում են, որ վնասումն առաջանում է ինտերլեյկին 15-ի արտազատմամբ և իմունային համակարգի ակտիվացմամբ ավելի կարճ գլուտենային պեպտիդով (պ31–43/49): Այն կառաջացներ լեյկոցիտներով էնտերոցիտների մահ էպիթելային հյուսվածքում[28]։ Բիոպսիայով տեսանելի թավիկային ապաճը կարող է նաև չկապակցված պատճառ ունենալ, ինչպես օրինակ տրոպիկական սպրուն, գիարդիազը և ճառագայթային էնտերիտը։ Եթե շճաբանական և տիպիկ բիոպսիան խոսում են ցելիակիայի մասին, բայց այն պատասխան չի տալիս պահպանված դիետային, պետք է մտածել վերոհիշյալ այլընտրանքային ախտորոշումների մասին[40]։
Ախտորոշում
խմբագրելԱխտորոշումը հաճախակի դժվարություն է ներկայացնում, քանզի դեռ 2019 թ. դրությամբ շատ բժիշկներ տեղեկացված չեն ցելիակիայի ախտանշանների դրսևորումների բազմազանության և ախտորոշիչ չափորոշիչների մասին, այդպիսով դեպքերը մեծամասամբ ախտորոշվում են զգալի ուշացմամբ[22][26]։ Ախտանշանների ի հայտ գալուց հետո մինչև տասներկու տարվա ընթացքում կարող է դրվել ախտորոշում, և մեծամասնությամբ շատ երկրներում կարող է այդպես էլ չախտորոշվել[26]։
Գոյություն ունեն որոշակի թեստեր, որոնք կարող են օգտագործվել։ Ախտանշանների մակարդակը կարող է որոշել թեստի ընտրությունը, սակայն «բոլոր» թեստերը անիմաստ են, եթե հիվանդը արդեն առանց գլուտենային սննդակարգով է սնվում։ Բարակ աղու վնասումը վերականգնվում է շաբաթների ընթացքում սննդակարգից գլուտենը բացառեուց հետո, իսկ հակամարմինների մակարդակը իջնում է ամիսների ընթացքում։ Նրանց, ովքեր արդեն բացառել են գլուտենը սննդակարգից, կարող է անհրաժեշտ լինել օգտագործել որոշ գլուտեն պարունակող մթերքներ վեց շաբաթների ընթացքում, մինչ կրկնակի հետազոտություն անցկացնելը[21]։
Արյան քննություն
խմբագրելԱրյան շճաբանական հետազոտությունը առաջին ընտրության քննություն է, որն անհրաժեշտ է ցելիակիայի ախտորոշման համար։ Դրա զգայունությունը կորելացվում է հյուսվածաբանական վնասումների աստիճանին։ Նվազագույն բարակ աղիքային փոփոխություններով մարդիկ կարող են սերոնեգատիվ լինել, այդ իսկ պատժառով ցելիակիայով տառապող մարդկանց մի մասը կարող է բաց թողնվել հայտնաբերման փուլում։ Թավիկային ատրոֆիայով պացիենտների մոտ իմունոգլոբուլին A տիպի հակաէնդոմիզիալ հակամարմինները կարող են ազդարարել զգայունության և սպեցիֆիկության մասին, համապատասխանաբար 90% և 99%[86]։ Հակատրանսգլուտամինազային հակամարմինների սերոլոգիան իսկզբանե զգայունության (99%) և սպեցիֆիկության (>90%) ավելի բարձր արդյունքների մասին էր խոսում։ Ինչևէ, հիմա համարվում է, որ այն ունի նմանատիպ բնորոշիչներ ինչ հակաէնդոմիզիալ հակամարմինները[86]։ Ե՛վ հակատրանսգլուտամինազային, և՛ հակաէնդոմիզիալ հակամարմինները ունեն դասական ախտանիշներով և լիարժեք թավիկային ատրոֆիայով ցելիակիայի ախտորոշման բարձր զգայնություն, բայց մասնակի ատրոֆիայով պացիենտների միայն 30–89%-ի դեպքում է հայտնաբերվում, իսկ լորձաթաղանթի աննշան փոփոխություններով թավիկների պահպանմամբ դեպքերում ավելի քիչ քան 50%[23][24]։
Հյուսվածքային տրանսգլուտամինազան ձևափոխում է գլուտեն պեպտիդը իմուն համակարգը ավելի արդյունավետ դրդող ձևի[28]։ Այս պեպտիդները հյուսվածքային տրանսգլուտամինազայի միջոցով ձևափոխվում են երկու եղանակով՝ դեզամինացում և տրանսամինացում[75]։ Ժամանակակից հակա-հՏԳ հետազոտությունը հենվում է ռեկոմբինանտ սպիտակուցի ընտրմամբ որպես հակածին[87]։ ՀՏԳ թեստավորումը պետք է իրականցվի առաջին հերթին, քանզի այն ավելի պարզ մեթոդ է իրականացման համար։ ՀՏԳ ոչ միանշանակ արդյունքի դեպքում դրան պետք է հաջորդի հակաէնդոմիզիալ հակամարմինների թեստը[21]։
Ուղեցույցներում խորհուրդ է տրվում զուգահեռ ստուգել շճային IgA մակարդակը, քանի որ ցելիակիայով հիվանդ մարդիկ, ովքեր ունեն IgA անբավարարություն, անկարող են սինթեզել հակամարմիններ, որոնք էլ հանդիսանում են այս թեստերի թիրախ («կեղծ բացասական»)։ Այդ մարդկանց մոտ կարող է հայտնաբերվել տրանսգլուտամինազայի հանդեպ IgG (IgG-tTG) հակամարմիններ[21][88]։
Եթե այս բոլո հակամարմինները բացասական են, ապա պետք է որոշել հակա-ԴԳՊ (դեզամինացված գլիադինի պեպտիդի հանդեպ հակամարմիններ)։ IgG դասի հակա-ԴԳՊ հակամարմինները կարող են օգտակար լինել IgA անբավարարությամբ տառապող անձանց մոտ։ Երկու տարեկանից ցածր երեխաների դեպքում, հակա-ԴԳՊ հակամարմինները ավելի ինֆորմատիվ են քան հակաէնդոմիզիալ ր հակատրանսգլուտամինազային հակամարմինների թեստերը[13]։
Ցելիակիայի ախտորոշման լայն արդյունքների պատճառով, մասնագիտացված ուղեցույցներում առաջարկվում է դրական արյուն քննությամբ մարդկանց այնուհետև կատարել էնդոսկոպիա/էզոֆագոգաստրոդուոդենոսկոպիա և բիոպսիա։ Շճաբանական թեստի բացասական պատասխանին կարող է հետևել էնդոսկոպիայի կամ դուոդենալ բիոպսիայի ցուցում, եթե կլինիկորեն դրսևորումը բարձր հավանականության մասին է խոսում[21][40][89]։
Պատմականորեն երեք հակամարմինային թեստեր են իրականացվել՝ հակառետիկուլինային (ARA), հակագլիադինային (AGA) և հակաէնդոմիզիալ (EMA)[90]: ARA թեստավորումը, սակայն, նպատակահարմար չէ մշտական հետազոտության համար[91]։ Շճաբանական թեստերը կարող են լինել ոչ հուսալի մինչև հինգ տարեկան երեխաների դեպքում, մինչդեռ հակագլիադինային թեստերն ավելի արդյունավետ են[90]։ Շճաբանական թեստերը հիմնված են անուղղակի իմունոֆլուորեսցենցիայի (ռետիկուլին, գլիադին և էնդոմիզիում) կամ ELISA (գլիադին կամ հյուսվածքային տրանսգլուտամինազա, հՏԳ) վրա[92]։
Այլ հակամարմիններ ինչպիսիք են հակասախարոմիցինային ցերեվիզիալ հակամարմինները, հանդիպում են ցելիակիայով հիվանդ որոշ մարդկանց մոտ, բայց նաև կարող են հանդիպել այլ աուտոիմուն հիվանդությունների դեպքում և մոտ 5% արյան դոնորների մոտ[93]։
Հակամարմինների հետազոտությունը կարող է զուգակցվել մարդու լեյկոցիտային հակամարմինների HLA թեստավորման հետ, եթե ախտորոշումը հստակ չէ։ TGA և EMA թեստերը ամենազգայուն շճաբանական հետազոտություններն են, բայց որպես HLA-DQ բացասական տիպը բացառում է ցելիակիա հիվանդության ախտորոշումը, HLA-DQ2- ի կամ DQ8-ի համար թեստավորումը առավելագույնի է հասցնում զգայունությունն ու կանխատեսող բացասական արդյունքները[61] However, widespread use of HLA typing to rule out coeliac disease is not currently recommended.[21]:
Էնդոսկոպիա
խմբագրելՏասներկումատնյա աղու վերին հատվածի էնդոսկոպիկ բիոպսիա(կոճղեզի հետին շրջանում կամ աղիճ աղում իրականացվում է մի քանի հատված ընդգրկելու համար (չորսից ութ))։ Ոչ բոլոր հատվածներն են միանման ախտահարված, և եթե բիոպսիան կատարվի առողջ հյուսվածքից, արդյունքը կլինի կեղծ բացասական[40]։ Նույնիսկ միևնույն բիոպտիկ հատվածում, կարող են տարբեր աստիճանի վնասումներ նկատվել[16]։
Ցելիակիայով հիվանդներից շատերի մոտ էնդոսկոպիկ քննությամբ բարակ աղիքը կարող է բնականոն տեսք ունենալ մինչ բիոպտատի ուսումնասիրության իրականացումը։ Այնուամենայնիվ, գոյություն ունեն հինգ բնորոշիչներ, որոնք օժտված են ցելիակիայի բարձր սպեցիֆիկությամբ՝ բարակ աղու ծալքերի կնճռոտում (պատկերված է նկարում), ծալքերի քանակի նվազում, լորձաթաղանթի խճանկարային պատկեր (նկարագրվում է ինչպես «ճաքճքած լաքաներ»), ենթալորձաթաղանթի արյունատար անոթի արտահայտվածություն և հանգուցավոր լորձաթաղանթի առկայություն[94]։
Եվրոպական ուղեցույցները երեխաների և դեռահասների դեպքում առաջարկում են ցելիակիայի համանման ախտանշանների դեպքում չանցկացնելի աղիքի բիոպսիա, եթե հակա-հՏԳ տիտրը շատ բարձր է (10 անգամ ավելի բարձր քան նորմայի վերին սահմանը)[13]։
Մինչև 1970-ականները, բիոպսիաները իրականացվում էին արտածծում իրականացնող սարքին ամրացված մետաղական կապսուլաներով։ Կապսուլաները կուլ էին տալիս և թույլ տալիս, որ հասնի բարակ աղիք։ Ռենտգեն հետազոտությամբ դիրքի ճշգրտումից հետո, միացվում էր արտածծման սարքը և հավաքվում էր աղիքային պատի պարունակությունը կապսուլայի մեջ։ Հաճախ կիրառվող կապսուլաներից էին համարվում Ուոթսոնի և Կրոսբի-Կուգլերի կապսուլաները։ Ներկայում այս մեթոդը փոխարինվել է ֆիբրոէնդոսկոպիկ եղանակով, որն ունի ավելի բարձր զգահյունություն և սխալվելու ավելի ցածր հավանականություն[95]։
Կապսուլային էնդոսկոպիան թույլ է տալիս հայտնաբերել ցելիակիային տիպիկ բնորոշ լորձաթաղանթի փոփոխությունները, սակայն հասարակ էնդոսկոպիայի և հյուսվածաբանական քննության համեմատ այն օժտված է ավելի ցածր զգայունությամբ։ Այդ պատճառով, այն չի հանդիսանում ցելիակիայի ախտորոշման առաջնային մեթոդ, սակայն կարող է ինֆորմատիվ լինել T-բջջային լիմֆոմայի, խոցային յեյունոիլեիտի և ադենոկարցինոմայի ախտորոշման համար, ռեֆրակտեր կամ բարդացած ցելիակիայի ընթացքով պացիենտների դեպքում[96]
Ախտաբանություն
խմբագրելՑելիակիայի դասական ախտայարումները բարակ աղիքում դասակարգվում են ըստ Մարշի[97]՝
- Մարշ աստիճան 0։ բնականոն լորձաթաղանթ
- Մարշ աստիճան 1։ ներէպիթելային լիմֆոցիտների քանակի աճ, սովորաբար գերազանցելով 20-ով 100 էրիթոցիտի հաշվարկով
- Մարշ աստիճան 2։ Լիբերկունյան գեղձերի պրոլիֆերացիա
- Մարշ աստիճան 3։ թավիկների մասնակի կամ լրիվ ատրոֆիա, գեղձերի հիպերտրոֆիա[98]
- Մարշ աստիճան 4։ բարակ աղիքի կառուցվածքային հիպոպլազիա
Մարշի դասակարգումը՝ առաջարկված 1992 թ., մասնակիորեն ձևափոխվել է 1999-ին վեց աստիճանի, որտեղ նախորդ դասակարգման երրորդ աստիճանը ստորաբաժանվել է երեք աստիճանի.[99]: Հետագա հետազոտությունները ցույց տվեցին, որ այս համակարգը միշտ չէ հուսալի և ցելիակիայի ժամանակ առաջացած փոփոխությունները կարելի է դասակարգել հետևյալ երեք բնութագրերով[18][100]՝
- A ներկայացված է լիմֆոցիտային ինֆիլտրացիայով նորմալ թավիկային ֆոնինrepresenting lymphocytic infiltration with normal villous appearance;
- B1 նկարագրում է մասնակի թավիկային ատրոֆիա, և
- B2 նկարագրում է լիարժեք թավիկային ատրոֆիա
Փոփոխությունները սովորաբար բարելավվում են կամ ախտադարձում առանց գլուտենային սննդակարգի արդյունքում։ Այնուամենայնիվ, շատ ուղեցույցներ խորհուրդ չեն տալիս կատարել կրկնակի բիոպսիա, եթե դիետայի ֆոնին ախտանշանների բարելավում չի նկատվում[40][89]։ Որոշ դեպքերում, կարող է հատուկ ավելացվել գլուտենի օգտագործումը, որին կհաջորդի բիոպսիան, հաստատելու կամ ժխտելու համար ցելիակիան, որից հետո բիոպսիայի և շճաբանական նորմալ պատասխանները կարող են վկայել սխալ ախտորոշման մասին[40]։
Չբուժված ցելիակիայի դեպքում, թավիկային ատրոֆիան ավելի հաճախ է հանդիպում երեք տարեկանից ցածր երեխաների մոտ, իսկ ավելի մեծ երեխաների և հասուն մարդկանց մոտ՝ սակավ աղիքային ախտահարումներ (դուոդենալ լիմֆոցիտոզ) նորմալ թավիկների առկայությամբ[5][25]։
Այլ ախտորոշիչ թեստեր
խմբագրելԱխտորոշման հաստատումից հետո կարող է անցկացվել հետագա քննություն, պարզելու բարդությունները, ինչպես օրինակ երկաթի անբավարարությունը (արյան ընդհանուր և երկաթի քննության արդյունքում), ֆոլաթթվի և վիտամին B12 անբավարարություն, հիպոկալցեմիա (կալցիումի ցածր մակարդակ, սովորաբար վիտամին D սակավության հետևանքով)։ Վահանագեղձի ֆունկցիոնալ թեստեր կարող են իրականացվել արյան քննության ընթացքում, պարզելու համար հիպոթիրոիդիզմի առկայությունը, որն ավելի հաճախ է հանդիպում ցելիակիայով մարդկանց մոտ[41]։
Օստեոպենիա և օստեոպորոզ, մեղմ և խիստ արտահայտված ոսկրային հանքայնեցման նվազում հաճախ առկա են ցելիակիայով հիվանդ մարդկանց մոտ, և ախտորոշիչ նպատակով կարող է անցկացվել ոսկրային խտության հետազոտություն, ինչպիսիք են DXA սքանավորումը, որը կատարվում է պարզելու համար կոտրվածխքների հավանականությունը և ոսկրի պահպանման դեղորայքային բուժման կարիքը[40][41]։
Գլյուտենի դուրսբերում
խմբագրելՉնայած արյան հակամարմինների թեստերը, բիոպսիաները և գենետիկ թեստերը սովորաբար պարզ ախտորոշում են[24][86], սակայն երբեմն անհրաժեշտություն է առաջանում գլուտենի բացառման, առանց գլուտենային սննդակարգի նշանակման, ավելի հստակ ախտորոշելու համար։ Ներկայումս, գլուտենային հրահրում չի պահանջվում ախտորոշումը հաստատելու նպատակով այն դեպքերում, երբ պացիենտը ունի ցելիակիային բնորոշ աղիքի փոփոխություններ և դրական արձագանք է տալիս առանց գլուտենայի դիետային[24]։ Այնուամենայնիվ, որոշ դեպքերում կարող է անհրաժեշտություն առաջանալ գլուտենային հրահրմամբ, դրան հաջորդող բիոպսիայով, ախտորոշումը հաստատելու նպատակով. օրինակ՝ ցելիակիայի բարձր կասկածով, բայց առանց բիոպսիոն հաստատման, ովքեր ունեն արյան մեջ բացասական հակամարմիններ և արդեն իսկ սնվում են առանց գլուտենային սննդակարգով[24]։ Գլուտենի ներմուծումը խորհուրդ չի տրվում մինչև հինգ տարեկան երեխաների և սեռահասունացման շրջանումG[101]: Ոչ ցելիակիային գլուտենային անանելիության ալտերնատիվ ախտորոշում կարող է դրվել, երբ առկա է միայն սիմպտոմատիկ գլուտենի հանդեպ զգայնություն[102]։ Ստամոքսաղիքային և արտաաղիքային ախտանշանները ոչ ցելիակիային գլուտենային զգայնության դեպքում կարող է նման լինել ցելիակիային հիվանդությանը[16], և բարելավվում են սննդակարգից գլուտենի վերացման դեպքում[103][104], ցելիակիան և ցորենի հանդեպ ալերգիան բացառելուց հետո[105]։
Մարդկանց մինչև 30%-ի մոտ հաճախ շարունակում են ունենալ կամ նրանց մոտ զարգանալ ախտանշանները սննդից գլուտենը հեռացնելուց հետո[7]։ Անհրաժեշտ է սիմտոմատիկ պատասխանի մանրակրկիտ վերլուծություն, քանզի պատասխանի բացակայությունը կարող է պայմանավորված լինել շարունակվող փոքր քանակներով գլուտենի կիրառմամբ, կամավոր կամ ակամա[5], կամ հետևանք լինել այլ հաճախ ասոցացված վիճակների հետ, ինչպես աղիքային բակտերիալ գերաճը, լակտազային անբավարարությունը, ֆրուկտոզի մալաբսորբցիա[106], սուկրոզա[107] և սորբիտոլ[108], մալաբսորբցիա, քկզոկրին ենթաստամոքսային անբավարարություն[109][110], միկրոսկոպիկ կոլիտ[110] և այլն։ Չբուժված ցելիակիայի դեպքում,սրանք սովորաբար անցողիկ վիճակներ են, որոնք առաջանում են աղիքի վնասման հետևանքով[107][108][111][112][113]։ Դրանք սովորաբար բարելավվում են առանց գլուտենային դիետայի սկսելու մի քանի ամիս անց, բայց կարող են պահանջել որոշ միջամտություներ, ինչպես պանկրեատիկ ֆերմենտների ավելացումն է[112][113], սննդային լակտոզայի, ֆրուկտոզայի, սակրոզայի և սորբիտոլի օգտագործման նվազեցումը[107][111] կամ հակաբիոտիկների պեր օրալ կիրառումը բակտերիալ գերաճի դեպքում[113]։ Բացի գլուտենի բացառումից, որոշ մարդիկ կարիք ունեն նաև հետևելու ցածր FODMAP դիետայի կամ խուսափել կոմերցիոն առանց գլուտենային սննդից, քանի որ դրանք պարունակում են մեծ քանակությամբ կոնսերվանտներ և հավելումներ (ինչպես սուլֆիտներ, գլուտամատ, նիտրատներ և բենզոատներ) և կարող են տրիգեր հանդիսանալ ֆունկցիոնալ ստամոքսաղիքային ախտանշանների համար[114]։
Սքրինինգ
խմբագրելԳիտնականները բանավիճում են սքրինինգի օգտակար լինելու հարցում։ Միացյալ Նահանգների կանխարգելիչ միջոցառումների թիրախային խումբը մինչ 2017թ. կատարված ուսումնասիրությունները, անբավարար գտավ անհրաժեշտությունը իրականացնել սքրինինգ առանց ախտանշանների մարդկանց մոտ[29]։ Միացյալ Թագավորությունում, Կլինիկական հմտությունների և առողջության ազգային ինստիտուտուտը (NICE) առաջարկեց ցելիակիայի համար թեստավորել արդեն հաստատված ախտորոշմամբ մարդկանց առաջին աստիճանի ազգակիցներին, ովքեր ունեն մշտական թուլություն, որովայնային կամ ստամոքսաղիքային ախտանշաններ, դանդաղած աճ, անբացատրելի քաշի կորուստ կամ երկաթի, վիտամին B12 կամ ֆոլաթթվի անբավարարություն, բերանում խիստ արտահայտված խոցոտումներ, ախտորոշված առաջին տիպի շաքարային դիաբետ, աուտոիմուն թիրեոիդիտ[21], նոր ախտորոշված քրոնիկական հոգնածության համախտանիշ[115] և գրգռված աղու համախտանիշ[37]։ Հերպետիկ մաշկաբորբը ընդգրկված է այլ ուղեցույցներում[116]։ NICE-ը նաև խորհուրդ է տալիս շճաբանական հետազոտություն այն մարդկանց մոտ, ովքեր ունեն ոսկրային մետաբոլիկ հիվանդություն (ոսկրերի հանքայնացման խտության նվազում կամ օստեոմալացիա), չբացատրված նյարդաբանական խանգարումներ (օրինակ՝ ծայրամասային նեյրոպաթիա և ատաքսիա), ռեպրոդուկցիայի խնդիրներ կամ կրկնակի վիժման դեպքեր, կայուն լյարդային ֆերմենտների բարձր մակարդակ անհայտ պատճառով, ատամների էմալի խնդիրներ և ախտորոշված Դաունի կամ Տերների համախտանիշ[21]։
Որոշ ուսումնասիրություններ պարզել են, որ վաղ ախտորոշումը նվազեցնում է առողջական խնդիրների զարգացման ռիսկը, ինչպիսիք են օստեոպորոզը, սակավարյունությունը, քաղցկեղի որոշ տեսակներ, նյարդաբանական խանգարումները, սիրտանոթային հիվանդությունները և վերարտադրողական խնդիրները[12][28][46][117][118]։ Այդ իսկ պատճառով խորհուրդ է տրվում հետազոտել կոնկրետ հիվանդություններով մարդկանց[118]։
Շճաբանական հետազոտությունը առաջարկվել էր որպես սքրինինգային մեթոդ, քանի որ հակամարմինների հայտնաբերումը թույլ կտար պարզել ցելիակիայի նախկինում չբացահայտված դեպքերը և կանխել դրա բարդությունները այդ մարդկանց շրջանում:[Այնուամենայնիվ, շճաբանական թեստերը օժտված են բարձր զգայունությամբ միայն այն դեպքերում, երբ առկա է տոտալ թավիկային ատրոֆիա, և ունեն շատ ցածր հնարավորություն հայտնաբերելու մասնակի թավիկային ատրոֆիայով քեյսերի կամ աղիքային նվազ ախտահարումների դեպքում դեպքում[24] Ցելիակիայի հայտնաբերման նպատակով կարելի է առաջարկել թեստավորում այն մարդկանց, ում մոտ առկա է հաճախակի ասոցացված վիճակներ[18][21]։
Բուժում
խմբագրելՍննդակարգ
խմբագրելՆերկայում, միակ արդյունավետ բուժումը հանդիսանում է ամբողջ կյանքի ընթացքում առանց գլուտենային դիետան[50]:Չկա ոչ մի դեղամիջոց, որը կկանխի վնասումը կամ օրգանիզմի հանդեպ գրոհը, եթե առկա է սննդում գլուտեն։ Սննդակարգի խիստ պահպանումը օգնում է աղիքի պատի վերականգնմանը, հանգեցնելով գրեթե բոլոր ախտանշանների վերացման դեպքերի մեծամասնությունում, և, կախված, թե ինչքան վաղ է սկսվել դիետան, հնարավոր է օստեոպորոզի և աղիքային քաղցկեղի ռիսկի նվազում կամ երբեմն վերացում[119]։ Դիետայի պահպանումը կարող է ծանր լինել. դրանից շեղումը կարող է հանգեցնել ախտադարձի։
Սննդաբանի օգնությունը անհրաժեշտ է, որպեսզի պացիենտը իմանա՝ որ մթերքներն են պարունակում գլուտեն, որոնք են անվնաս, և ինչպես սնվել բալանսավորված չնայած սահմանափակումներին։ Շատ երկրներում, առանց գլուտենի մթերքները հասանելի են բժշկի դեղատոմսով և կարող են բժշկական ապահովագրության ոլորտում լինել։ Առանց գլուտենի սննդամթերքը սովորաբար ավելի թանկ է և ավելի դժվար է գտնել քան գլուտեն պարունակողները[120]։ Քանի որ պատրաստի սնունդը կարող է պարունակել գլուտենի մնացորդներ, ցելիակիայով հիվանդ մարդկանց մի մասը նախընտրում է այն պատրաստել զրոյից[121]։
«Առանց գլուտեն» տերմինը հիմնականում գործածվում է չնչին, ոչ վնասակար քանակը ցույց տալու համար, քան դրա իսպառ բացակայությունը[122]։ Գլուտենի անվտանգ չափաբաժնի հստակ քանակը դեռ պարզ չէ և վիճելի է։ Վերջին համակարգային հետազոտությունները թույլատրում են հասկանալ ենթադրյալ չափաբաժինը, ըստ որի օրական 10 մգ-ից պակաս գլուտենի օգտագործումը հյուսվածաբանական փոփոխությունների առաջացմանքիչ հավանականություն է պարունակում, չնայած, նշվում է որ կատարված հուսալի հետազոտությունների քանակը բավարար չեն[122]։ «Առանց գլուտեն» անվանման կարգավորումը փոփոխական է։ Եվրոպական միությունում, Եվրոպական կոմիտեի 2009թ. որոշմամբ «առանց գլուտեն» տերմինը սահմանվում է 20 մգ/կգ, իսկ «շատ քիչ գլուտեն» տերմինը՝ ավելի քիչ քան 100 մգ/կգ հաշվարկով[123]։ Միացյալ Նահանգներում, Սննդի և դեղորայքի ադմինիստրացիան (FDA) 2013թ. հրապարակեց «առանց գլուտեն» տիտղոսի սահմանափակումը ավելի քիչ քան գլուտենի 20 մասնիկ մեկ միլիոնի հաշվարկով[124][125][126]։ Ներկայիս միջազգային «Կոդեքս ալիմենտարիուս»-ի ստանդարտներով թույլատրվում է մինչև 20 պմիլ այսպես կոչված «առանց գլուտեն» մթերքների համար[127]։ Որոշ կազմակերպություններ, ինչպես օրինակ առանց գլուտեն սետիֆիկացման կազմակերպությունը (GFCO), Ցելիակիայի ասոցիացիան (CSA), Ցելիակիայի տեղեկացման ազգային հիմնադրամը (NFCA), նույնպես կարող են հավատարմագրել մթերքները և կազմակերպությունները որպես «առանց գլուտեն»[128]։
Առանց գլուտենային դիետան բարելավում է առողջապահական տեսանկյունից կյանքի որակը, իսկ սննդակարգին խիստ հետևելը տալիս է ավելի լավ արդյունք, քան դրա մասնակի պահպանումը։ Այնուամենայնիվ, դիետայի պահպանումը ամբողջությամբ չի կարող նորմայի հասցնել կյանքի որակը[129]։
Ռեֆրակտեր հիվանդություն
խմբագրելՇուրջ 0.3%-10% մարդկանց մոտ առկա է ռեֆրակտեր հիվանդություն, ինչը նշանակում է, որ նրանց մոտ առկա է մշտական թավիկային ատրոֆիա, անկախ անաց գլուտենային ֆիետայի պահպանումից 12 ամսից երկար ժամանակում[110]։ Այնուամենայնիվ, գլուտենի ոչ գիտակցված օգտագործումը հանդիսանում է թավիկային մնայուն ատրոֆիայի հիմնական պատճառը, հետևաբար, այն պետք է բացառվի մինչ ռեֆրակտեր հիվանդություն ախտորոշման հաստատումը[110]։ Քիչ հիմնային գիտելիքներով և առանց գլուտենային սննդակարգի մասին էիչ պտկերացում ունեցող մարդիկ կարող են վստահ լինել, որ խստորեն հետևում են դիետային, սակայն պարբերաբար սխալներ կատարեն[7][110][130]։ Ինչպես նաև, ախտանշանների բացակայությունը աղիքների թավիկների վերականգնման հուսալի ցուցանիշ չեն հանդիսանում[110]։
Եթե թավիկները վնասող գործոնները վերացվել են, գլուկոկորտիկոիդների կամ իմունաճնշիչ դեղորայքի (ինչպես օրինակ ազաթիոպրինը) կիրառումը կարող է նպատակահարմար լինել նշված սցենարում[40]։
Ռեֆրակտեր ցելիակիան պետք է տարբերակել ախտանիշանների մշտական պահպանումից անկախ գլուտենի բացառումից սննդակարգում[110], որի պատճառ են հանդիսանում աղիքային վնասումների հետւանքով տրանզիտոր վիճակները[107][108][111], որոնք սովորաբար խորանում կամ բարելավվում են ամիսներ արունակ առանց գլուտենի սնվելու հետևանքով[112][113], ինչպես օրինակ բարակ աղիքի բակտերիալ ֆլորայի ավելացում, լակտոզային անտանելիություն, ֆրուկտոզայի տերներծծում[106] sucrose[107], և սորբիտոլի[108] մալաբսորբցիա, ենթաստամոքսային գեղձի էկզոկրին անբավարարություն[109][110] և միկրոսկոպիկ կոլիտ[110]։
Համաճարակաբանություն
խմբագրելՈղջ աշխարհում ցելիակիայով տառապում են 1:100-1:170 մարդ[14][131]։ հավանականությունը, սակայն, տատանվում է կախված աշխարհի տարբեր տարածաշրջաններից. ինչպես 1:300, այնպես էլ ամենահաճախը՝ 1:40[14]: Միացյալ նահանգներում կարծում են, որ որ ախտահարվում են 1:1750-ից (նկարագրվում են որպես կլինիկական հիվանություն ներառելով հերպետիկ մաշկաբորբ սահմանափակ ստամոքսաղիքային ուղու ախտանշաններով) 1:105-ի (նկարագրվում է տրանսգլուտամինազային IgA առկայությամբ արյան դոնորների շրջանում)[132]։ Փոփոխական նշանների և ախտանիշների պատճառով ենթադրվում է, որ հիվանդների մոտ 85% -ը ախտորոշված չէ[133]։ Կլինիկորեն ախտորոշված հիվանդություն ունեցող մարդկանց տոկոսը (ախտանիշներ, որոնք դրդում են ախտորոշիչ թեստերի) տարբեր հետազոտություններում կազմում է 0,05–0,27%: Այնուամենայնիվ, Եվրոպայի, Հնդկաստանի, Հարավային Ամերիկայի, Ավստրալիայի և ԱՄՆ-ի բնակչության մի մասի շրջանում ուսումնասիրությունները (օգտագործելով շճաբանական թեստեր և բիոպսիա) ցույց են տալիս, որ հիվանդություն ունեցող մարդկանց տոկոսը երեխաների մոտ կարող է լինել 0.33-ից 1.06% -ի սահմաններում (բայց ուսումնասիրություններից մեկում 5.66% Սահրավիի նախատրամադրվածություն ունեցող երեխաների մոտ[134])) և մեծահասակների մոտ ՝ 0,18–1,2%[28]: Առաջնային օգնության շրջանակում, ովքեր ունեն ստամոքսաղիքային տրակրի ախտանշաններ, ցելիակիայի հավանականությունը կազմում է 3%.[86]:Ավստրալիայում մոտավորապես մեկը 70 մարդուց տառապում է այս հիվանդությամբ[135]։ Հաճախականությունը մեծահասակ արյան դոնորն երի շրջանում Իրանից, Իսրայելից, Սիրիայից և Թուրքիայից համապատասխանաբար կազմում է 0.60%, 0.64%, 1.61% և 1.15%[39]:
Աֆրիկյան, ճապոնական և չինական ծագում ունեցող մարդկանց մոտ հիվանդությունը հազվադեպ է ախտորոշվում[136], սա արտացոլում է գենետիկական ռիսկի գործոնների, ինչպիսիք են HLA-B8, շատ ավելի ցածր տարածվածությունը[137]։ Հնդկական ծագում ունեցող մարդիկ, կարծես, ունեն ռիսկի նույն հավանականությունը, ինչ արևմտյան Կովկասի մարդկանց շրջանում[39]։ Պոլպուլյացիոն ուսումնասիրությունները ցույց են տվել, որ ցելիակիայով հիվանդների մեծ մասը մնում են չախտորոշված. մասամբ դա պայմանավորված է բժիշկների՝ այս հիվանդության մասին ոչ բավարար տեղեկությամբ, իսկ երբեմն այն պատճառով, որ հիվանդությունը կարող է ընթանալ ասիմպտոմ[138]։ Ցելիակիան ավելի շատ հանդիպում է կանանց քան տղամարդկանց մոտ[32]։ ԱՄՆ-ում խոշոր բազմակենտրոն հետազոտությունները հայտնաբերեցին 0.75% հավանականություն ոչ ռիսկի խմբում գտնվողների, աճող մինչև 1.8% սիմպտոմատիկ մարդկանց մոտ, ցելիակիայով հիվանդների երկրորդ աստիճանի ազգականների 2.6% մոտ(տատիկներ, պապիկներ, թոռներ, հորաքույրներ և այլն) և 4.5% առաջին աստիճանի ազգականների մոտ (քույրեր, եղբայրներ, ծնողներ և երեխաներ)[39]։ Այս պրոֆիլը համապատասխանում է ցելիակիայի տարածվածությանը Եվրոպայում[39]։ Ցելիակիայի բարձր ռիսկի այլ պոպուլյացիաներում հավանականությունը տատանվում է 5%-10%, ներառյալ Դաունի համախտանիշով, Տերների համախտանիշով, առաջին տիպի դիաբետով և վահանագեղձի աուտոիմուն հիվանդություններով, այդ թվում և՛ թեֆունկցիան, և՛ գերֆունկցիան[139]։
Պատմականորեն համարվում էր, որ ցելիակիան հանդիպում է շատ հազվադեպ, 0.02% հաճախությամբ[139]։ Հվանդությամն գրանցված դեպքերի այսչափ աճի պատճառը անհասկանալի է[131]։ մասամբ դա կարելի է բացատրել ախտորոշման հնարավորությունների ընդլայնմամբ[140]։ Ինչպես նաև ենթադրելի է, որ շուրջ 4.5 անգամ քանակի ավելացումը կարող է պայմանավորված լինել արևտյան միջավարում բակտերիաների և այլ պաթոգենների նվազ դրսևորմամբ[131]։ Միացյալ նահանգներում ախտորոշման միջին տարիքը համարվում է 38-ը[141]։ Մետավորապես պացիենտների 20 տոկոսի մոտ ցելիակիայի ախտորոշումը կատարվում է 60 տարեկանից հետո[141]։
Պատմություն
խմբագրել"Ցելիակիա" տերմինը առաջացել է հունարեն κοιλιακός (koiliakós, "որովայնային") և թարգմանվել է 19-րդ դարում որպես հին հունական հիվանդություն Արեթեուս Կապադովկիացու կողմից[142][143]
Մարդիկ առաջին անգամ սկսել են մշակել հացահատիկներ Նեոլիթիկ դարաշրջանում (սկիզբը մոավորապես 9500 մ.թ.ա.) պտղաբեր կիսալուսնի շրջանում Արևմտյան Ասիայում, և շատ հավանական է, որ ցելիակիան մինչ դա չի առաջացել։ Արեթեուս Կապադովկիացին, ապրելով երեկրորդ դարում նույն տարածաշրջանում, նկարագրեց քրոնիկ դիարեայով ուղեկցվող մալաբսորտիվ համախտանիշ, որը հանգեցնում էրամբողջ մարմնի հյուծման[142]։ Նրա "Cœliac Affection" (ցելիակիային հունարենκοιλιακός koiliakos, "որովայնային") գրավեց արևմտյան բժշկության ուշադրությունը երբ Ֆրանսիս Ադամսը ներկայացրեց Արեթեուսի աշխատանքի թարգմանությունը 1856 թվականին Սիդենհամի հասարակությանը։ Արեթեուսի աշխատանքներում նկարագրված պացիենտները նշում էին ստամոքսի ցավ, հյուսված էին, գունատ և անաշխատունակ։ Փորլուծությունը նկարագրվում էր որպես սպիտակ հեղուկ դեֆեկացիա, գարշահոտով և փորափքանքով, հիվանդությունը դժվարությամբ էր բուժվում, և պարբերաբար կրկնվելու միտում ուներ։ Ըստ Արեթեուսի խնդիրը ստամոքսում ոչ բավարար ջերմությունն է, որը խանգարում է մարսողությանը, և սննդանյութերը չեն բաշխվում ամբողջ օրգանիզմում, ինչի հետևանքով առաջանում է փորլուծություն։ Նա համարում էր այս հիվանդությունը մեծահասակների, և ավելի շատ կանանց հիվանդություն, բացառելով երեխաների ախտահարումը։ Ապտճառը, ըստ Արիթեուսի, այլ քրոնիկ հիվանդությունն էր, իսկ երբեմն «սառը ջրի մեծ կումը»[142][143]
Մանկաբույժ Սամուել Ջին առաջին անգամ լեկցիային նկարագրել է հիվանդության ժամանակակից տեսքը երեխաների մոտ Great Ormond Street հոսպիտալում, Լոնդոնում 1887թվականին։ Ջին ընդունեց նախկին նկարագրությունները և տերմինները, ինչպես նաև հիվանդության անունը, ինչ առաջարկել էր Արիթեուսը։ Ջին պաշտոնապես հայտարարեց, որ եթե պացիենտին առհասարակ հնարավոր լինի բուժել, ապա դա հնարավոր կլինի միայն սննդակարգի միջոցով։ Ջին հասկացավ, որ կաթի անտանելիությունը կապակցված է ցելիակիայի հետ, և բարձր օսլայի պարունակությամբ մթերքները պետք է բացառել սննդակարգից։
Հետազոտական ուղղություններ
խմբագրելՄիջավայրային գործոնների որոնումը, որոնք կարող էին պատասխանատու լինել գենետիկորեն նախատրամադրված մարդկանց մոտ գլուտեն անհանդուրժողականության, հանգեցրել է հետազոտական գործունեության ընդլայնմանը` դիտարկելով նաև ստամոքս-աղիքային ինֆեկցիաները[144]։ 2017-ի ապրիլին հրապարակված հետազոտությունները ենթադրում են, որ հաճախակի անախտանշանային վարակը ռեովիրուսի ընդհանուր շտամով կարող է մեծացնել զգայունությունը գլուտեն պարունակող մթերքների հանդեպ[145]։
Շատ բուժման պլաններ են ուսումնասիրվում, ներառյալ նրանք, որոնք կնվազեցնեն դիետայի պահպանման անհրաժեշտությունը։ Բոլորը եղանակները ուսումնասիրման փուլում են, և առաջիկայում չի սպասվում, որ հասանելի կդարնան հասարակության համար[28][146][147]։
Առաջարկվել է երեք հիմնական մոտեցում՝ որպես ցելիակիա հիվանդության նոր բուժման եղանակ՝ գլյուտենի դետոքսիկացիա, աղիների թափանցելիության մոդուլյացիա և իմունային պատասխանի փոփոխում[148]։
Գենետիկորեն մշակված ցորենի տեսակների կամ հացահատիկների օգտագործումը, որոնք ընտրովի մշակվել են որպես նվազագույն իմունոգեն, չեն բացառում դրանց օգտագործումը։ Սակայն այն կարող է խոչընդոտել գլիադինի ազդեցությունը և ազդել խմորի որակի վրա։ Այլընտրանքային տարբերակով գլուտենի ազդեցությունը հնարավոր է նվազագույնի հասցնել ֆերմենտների համադրությամբ (պրոլիլ էնդոպեպտիդազ և գարու գլուտամին-սպեցիֆիկ ցիստեինէնդոեպեպտիդազ (EP-B2)), որը քայքայում է ենթադրյալ 33-մերային պեպտիդը տասներկումատնյա աղիքում[28]։
Հետազոտության փուլում գտնվող այլընտրանքային բուժումները ներառում են զոնուլինի, էնդոգեն ազդանշանային սպիտակուցի արգելակումը, որը կապված է աղիքի պատի թափանցելիության բարձրացման հետ, և, հետևաբար, բարձրացնում է գլիադինի ներկայացումը իմունային համակարգին։ Այս ուղու ինհիբիտոր հանդիսանում է լարազոտիդ ացետատը, որը ծրագրավորված է 3-րդ փուլում գտնվող կլինիկական փորձարկումների համար[149]։
Ցելիակիայով հիվանդների իմունային պատասխանը մոդուլյացիայի ենթարկելու վերաբերյալ փորձերը հիմնականում մնում են կլինիկական թեստավորման I փուլում. մեկ գործոն (CCX282-B) գնահատվել է որպես կլինիկական փորձարկման II փուլ՝ ցելյակիայով տառապող մարդկանցից վերցված բարակ աղիքի բիոպսիաների հիման վրա՝ գլուտենի ազդեցությունից առաջ և հետո[148]։
Չնայած, որ այն լայնորեն կիրառվում է որպես աուտիզմի այլընտրանքային բուժում, չկա ոչ մի ապացույց որ առանց գլուտենային դիետան օգուտ է տալիս[150][151][152]։ Գլուտենի հանդեպ զգայունություն ունեցող մարդկանց ենթախմբում, կան սահմանափակ տվյալներ, որ առանց գլուտենային սննդակարգը որոշակի դրական արդյունք ունի աուտիզմի դրսևորման որոշ տեսակների վրա[150][153][154]
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 Tovoli F, Masi C, Guidetti E, Negrini G, Paterini P, Bolondi L (2015 թ․ մարտ). «Clinical and diagnostic aspects of gluten related disorders». World Journal of Clinical Cases (Review). 3 (3): 275–84. doi:10.12998/wjcc.v3.i3.275. PMC 4360499. PMID 25789300.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Fasano A (2005 թ․ ապրիլ). «Clinical presentation of celiac disease in the pediatric population». Gastroenterology (Review). 128 (4 Suppl 1): S68–73. doi:10.1053/j.gastro.2005.02.015. PMID 15825129.
- ↑ «Symptoms & Causes of Celiac Disease | NIDDK». National Institute of Diabetes and Digestive and Kidney Diseases. 2016 թ․ հունիս. Արխիվացված օրիգինալից 2017 թ․ ապրիլի 24-ին. Վերցված է 2017 թ․ ապրիլի 24-ին.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 «Celiac Disease». NIDDKD. 2015 թ․ հունիս. Արխիվացված օրիգինալից 2016 թ․ մարտի 13-ին. Վերցված է 2016 թ․ մարտի 17-ին.
- ↑ 5,0 5,1 5,2 5,3 Vivas S, Vaquero L, Rodríguez-Martín L, Caminero A (2015 թ․ նոյեմբեր). «Age-related differences in celiac disease: Specific characteristics of adult presentation». World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 6 (4): 207–12. doi:10.4292/wjgpt.v6.i4.207. PMC 4635160. PMID 26558154. «In addition, the presence of intraepithelial lymphocytosis and/or villous atrophy and crypt hyperplasia of small-bowel mucosa, and clinical remission after withdrawal of gluten from the diet, are also used for diagnosis antitransglutaminase antibody (tTGA) titers and the degree of histological lesions inversely correlate with age. Thus, as the age of diagnosis increases antibody titers decrease and histological damage is less marked. It is common to find adults without villous atrophy showing only an inflammatory pattern in duodenal mucosa biopsies: Lymphocytic enteritis (Marsh I) or added crypt hyperplasia (Marsh II)»
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Ferri, Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders (2nd ed.). Philadelphia, PA: Elsevier/Mosby. էջ Chapter C. ISBN 978-0323076999.
- ↑ 7,0 7,1 7,2 7,3 See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (2015 թ․ հոկտեմբեր). «Practical insights into gluten-free diets». Nature Reviews. Gastroenterology & Hepatology (Review). 12 (10): 580–91. doi:10.1038/nrgastro.2015.156. PMID 26392070. «A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. Furthermore, up to 30% of patients continue to have gastrointestinal symptoms despite a strict GFD.122,124 If adherence is questioned, a structured interview by a qualified dietitian can help to identify both intentional and inadvertent sources of gluten.»
- ↑ 8,0 8,1 Lebwohl B, Ludvigsson JF, Green PH (2015 թ․ հոկտեմբեր). «Celiac disease and non-celiac gluten sensitivity». BMJ (Review). 351: h4347. doi:10.1136/bmj.h4347. PMC 4596973. PMID 26438584. «Celiac disease occurs in about 1% of the population worldwide, although most people with the condition are undiagnosed. It can cause a wide variety of symptoms, both intestinal and extra-intestinal because it is a systemic autoimmune disease that is triggered by dietary gluten. Patients with coeliac disease are at increased risk of cancer, including a twofold to fourfold increased risk of non-Hodgkin's lymphoma and a more than 30-fold increased risk of small intestinal adenocarcinoma, and they have a 1.4-fold increased risk of death.»
- ↑ 9,0 9,1 9,2 Lundin KE, Wijmenga C (2015 թ․ սեպտեմբեր). «Coeliac disease and autoimmune disease-genetic overlap and screening». Nature Reviews. Gastroenterology & Hepatology (Review). 12 (9): 507–15. doi:10.1038/nrgastro.2015.136. PMID 26303674. «The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.»
- ↑ 10,0 10,1 10,2 «Celiac disease». World Gastroenterology Organisation Global Guidelines. 2016 թ․ հուլիս. Արխիվացված օրիգինալից 2017 թ․ մարտի 17-ին. Վերցված է 2017 թ․ ապրիլի 23-ին.
- ↑ 11,0 11,1 11,2 11,3 Ciccocioppo R, Kruzliak P, Cangemi GC, Pohanka M, Betti E, Lauret E, Rodrigo L (2015 թ․ հոկտեմբերի 22). «The Spectrum of Differences between Childhood and Adulthood Celiac Disease». Nutrients (Review). 7 (10): 8733–51. doi:10.3390/nu7105426. PMC 4632446. PMID 26506381. «Several additional studies in extensive series of coeliac patients have clearly shown that TG2A sensitivity varies depending on the severity of duodenal damage, and reaches almost 100% in the presence of complete villous atrophy (more common in children under three years), 70% for subtotal atrophy, and up to 30% when only an increase in IELs is present. (IELs: intraepithelial lymphocytes)»
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 12,0 12,1 Lionetti E, Francavilla R, Pavone P, Pavone L, Francavilla T, Pulvirenti A, Giugno R, Ruggieri M (2010 թ․ օգոստոս). «The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis». Developmental Medicine and Child Neurology. 52 (8): 700–7. doi:10.1111/j.1469-8749.2010.03647.x. PMID 20345955.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP, ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (2012 թ․ հունվար). «European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease» (PDF). J Pediatr Gastroenterol Nutr (Practice Guideline). 54 (1): 136–60. doi:10.1097/MPG.0b013e31821a23d0. PMID 22197856. Արխիվացված (PDF) օրիգինալից 2016 թ․ ապրիլի 3-ին. «Since 1990, the understanding of the pathological processes of CD has increased enormously, leading to a change in the clinical paradigm of CD from a chronic, gluten-dependent enteropathy of childhood to a systemic disease with chronic immune features affecting different organ systems. (...) atypical symptoms may be considerably more common than classic symptoms»
- ↑ 14,0 14,1 14,2 14,3 Fasano A, Catassi C (2012 թ․ դեկտեմբեր). «Clinical practice. Celiac disease». The New England Journal of Medicine (Review). 367 (25): 2419–26. doi:10.1056/NEJMcp1113994. PMID 23252527.
- ↑ Newnham, Evan D (2017). «Coeliac disease in the 21st century: Paradigm shifts in the modern age». Journal of Gastroenterology and Hepatology. 32: 82–85. doi:10.1111/jgh.13704. PMID 28244672. «Presentation of CD with malabsorptive symptoms or malnutrition is now the exception rather than the rule.»Կաղապար:Free access
- ↑ 16,0 16,1 16,2 Tonutti E, Bizzaro N (2014). «Diagnosis and classification of celiac disease and gluten sensitivity». Autoimmun Rev. 13 (4–5): 472–6. doi:10.1016/j.autrev.2014.01.043. PMID 24440147.
- ↑ 17,0 17,1 17,2 Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (2013 թ․ նոյեմբեր). «Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet». Nutrients (Review). 5 (11): 4553–65. doi:10.3390/nu5114553. PMC 3847748. PMID 24253052.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 18,00 18,01 18,02 18,03 18,04 18,05 18,06 18,07 18,08 18,09 18,10 18,11 Di Sabatino A, Corazza GR (2009 թ․ ապրիլ). «Coeliac disease». Lancet. 373 (9673): 1480–93. doi:10.1016/S0140-6736(09)60254-3. PMID 19394538.
- ↑ Pinto-Sánchez MI, Causada-Calo N, Bercik P, Ford AC, Murray JA, Armstrong D, Semrad C, Kupfer SS, Alaedini A, Moayyedi P, Leffler DA, Verdú EF, Green P (2017 թ․ օգոստոս). «Safety of Adding Oats to a Gluten-Free Diet for Patients With Celiac Disease: Systematic Review and Meta-analysis of Clinical and Observational Studies» (PDF). Gastroenterology. 153 (2): 395–409.e3. doi:10.1053/j.gastro.2017.04.009. PMID 28431885.
- ↑ 20,0 20,1 20,2 20,3 20,4 Comino I, Moreno M, Sousa C (2015 թ․ նոյեմբեր). «Role of oats in celiac disease». World Journal of Gastroenterology. 21 (41): 11825–31. doi:10.3748/wjg.v21.i41.11825. PMC 4631980. PMID 26557006. «It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.»
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 21,0 21,1 21,2 21,3 21,4 21,5 21,6 21,7 21,8 National Institute for Health and Clinical Excellence. Clinical guideline 86: Recognition and assessment of coeliac disease. London, 2015.
- ↑ 22,0 22,1 Matthias T, Pfeiffer S, Selmi C, Eric Gershwin M (2010 թ․ ապրիլ). «Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope». Clin Rev Allergy Immunol (Review). 38 (2–3): 298–301. doi:10.1007/s12016-009-8160-z. PMID 19629760.
- ↑ 23,0 23,1 23,2 Lewis NR, Scott BB (2006 թ․ հուլիս). «Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)». Alimentary Pharmacology & Therapeutics. 24 (1): 47–54. doi:10.1111/j.1365-2036.2006.02967.x. PMID 16803602.
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 Rostom A, Murray JA, Kagnoff MF (2006 թ․ դեկտեմբեր). «American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease». Gastroenterology (Review). 131 (6): 1981–2002. doi:10.1053/j.gastro.2006.10.004. PMID 17087937.
- ↑ 25,0 25,1 Molina-Infante J, Santolaria S, Sanders DS, Fernández-Bañares F (2015 թ․ մայիս). «Systematic review: noncoeliac gluten sensitivity». Alimentary Pharmacology & Therapeutics (Review). 41 (9): 807–20. doi:10.1111/apt.13155. PMID 25753138. «Furthermore, seronegativity is more common in coeliac disease patients without villous atrophy (Marsh 1-2 lesions), but these 'minor' forms of coeliac disease may have similar clinical manifestations to those with villous atrophy and may show similar clinical–histological remission with reversal of haematological or biochemical disturbances on a gluten-free diet (GFD).»
- ↑ 26,0 26,1 26,2 26,3 Cichewicz AB, Mearns ES, Taylor A, Boulanger T, Gerber M, Leffler DA, և այլք: (2019 թ․ մարտի 1). «Diagnosis and Treatment Patterns in Celiac Disease». Dig Dis Sci (Review). 64 (8): 2095–2106. doi:10.1007/s10620-019-05528-3. PMID 30820708.
- ↑ 27,0 27,1 Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, Ciacci C (2015 թ․ ապրիլ). «Support for patients with celiac disease: A literature review». United European Gastroenterology Journal (Review). 3 (2): 146–59. doi:10.1177/2050640614562599. PMC 4406900. PMID 25922674.
- ↑ 28,00 28,01 28,02 28,03 28,04 28,05 28,06 28,07 28,08 28,09 28,10 28,11 28,12 28,13 28,14 28,15 van Heel DA, West J (2006 թ․ հուլիս). «Recent advances in coeliac disease». Gut (Review). 55 (7): 1037–46. doi:10.1136/gut.2005.075119. PMC 1856316. PMID 16766754.
- ↑ 29,0 29,1 Bibbins-Domingo K, Grossman DC, Curry SJ, Barry MJ, Davidson KW, Doubeni CA, Ebell M, Epling JW, Herzstein J, Kemper AR, Krist AH, Kurth AE, Landefeld CS, Mangione CM, Phipps MG, Silverstein M, Simon MA, Tseng CW (2017 թ․ մարտ). «Screening for Celiac Disease: US Preventive Services Task Force Recommendation Statement». JAMA. 317 (12): 1252–1257. doi:10.1001/jama.2017.1462. PMID 28350936.
- ↑ Burkhardt, J. G.; Chapa-Rodriguez, A.; Bahna, S. L. (2018 թ․ հուլիս). «Gluten sensitivities and the allergist: Threshing the grain from the husks». Allergy. 73 (7): 1359–1368. doi:10.1111/all.13354. PMID 29131356.
- ↑ 31,0 31,1 Lionetti E, Gatti S, Pulvirenti A, Catassi C (2015 թ․ հունիս). «Celiac disease from a global perspective». Best Practice & Research. Clinical Gastroenterology (Review). 29 (3): 365–79. doi:10.1016/j.bpg.2015.05.004. PMID 26060103.
- ↑ 32,0 32,1 Hischenhuber C, Crevel R, Jarry B, Mäki M, Moneret-Vautrin DA, Romano A, Troncone R, Ward R (2006 թ․ մարտ). «Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease». Alimentary Pharmacology & Therapeutics. 23 (5): 559–75. doi:10.1111/j.1365-2036.2006.02768.x. PMID 16480395.
- ↑ Schuppan D, Zimmer KP (2013 թ․ դեկտեմբեր). «The diagnosis and treatment of celiac disease». Deutsches Arzteblatt International. 110 (49): 835–46. doi:10.3238/arztebl.2013.0835. PMC 3884535. PMID 24355936.
- ↑ Vriezinga SL, Schweizer JJ, Koning F, Mearin ML (2015 թ․ սեպտեմբեր). «Coeliac disease and gluten-related disorders in childhood». Nature Reviews. Gastroenterology & Hepatology (Review). 12 (9): 527–36. doi:10.1038/nrgastro.2015.98. PMID 26100369.
- ↑ Ferguson R, Basu MK, Asquith P, Cooke WT (1976). «Jejunal mucosal abnormalities in patients with recurrent aphthous ulceration». Br Med J. 1 (6000): 11–13. doi:10.1136/bmj.1.6000.11. PMC 1638254. PMID 1247715.
- ↑ 36,0 36,1 Irvine, AJ; Chey, WD; Ford, AC (2017 թ․ հունվար). «Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis» (PDF). The American Journal of Gastroenterology. 112 (1): 65–76. doi:10.1038/ajg.2016.466. PMID 27753436.
- ↑ 37,0 37,1 National Institute for Health and Clinical Excellence. Clinical guideline 61: Irritable bowel syndrome. London, 2008.
- ↑ Fasano Alessio, Caio Giacomo; Catassi Carlo, Volta Umberto (2019 թ․ հուլիս). «Celiac disease: a comprehensive current review». BMC Medicine. Springer Nature. 17 (1): 142. doi:10.1186/s12916-019-1380-z. PMC 6647104. PMID 31331324.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 39,0 39,1 39,2 39,3 39,4 Gujral N, Freeman HJ, Thomson AB (2012 թ․ նոյեմբեր). «Celiac disease: prevalence, diagnosis, pathogenesis and treatment» (PDF). World Journal of Gastroenterology. 18 (42): 6036–59. doi:10.3748/wjg.v18.i42.6036. PMC 3496881. PMID 23155333. Արխիվացված է օրիգինալից (PDF) 2014 թ․ մարտի 20-ին.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 40,0 40,1 40,2 40,3 40,4 40,5 40,6 40,7 «American Gastroenterological Association medical position statement: Celiac Sprue». Gastroenterology. 120 (6): 1522–5. 2001. doi:10.1053/gast.2001.24055. PMID 11313323.
- ↑ 41,0 41,1 41,2 Presutti RJ, Cangemi JR, Cassidy HD, Hill DA (2007). «Celiac disease». Am Fam Physician. 76 (12): 1795–802. PMID 18217518. Արխիվացված է օրիգինալից 2021 թ․ ապրիլի 19-ին. Վերցված է 2020 թ․ օգոստոսի 26-ին.
- ↑ 42,0 42,1 Pietzak MM (2014). «Dietary supplements in celiac disease». In Rampertab SD, Mullin GE (eds.). Celiac disease. էջեր 137–59. ISBN 978-1-4614-8559-9.
- ↑ Cunningham-Rundles C (2001 թ․ սեպտեմբեր). «Physiology of IgA and IgA deficiency». J. Clin. Immunol. 21 (5): 303–9. doi:10.1023/A:1012241117984. PMID 11720003.
- ↑ Marks J, Shuster S, Watson AJ (1966). «Small-bowel changes in dermatitis herpetiformis». Lancet. 2 (7476): 1280–2. doi:10.1016/S0140-6736(66)91692-8. PMID 4163419.
- ↑ Nicolas ME, Krause PK, Gibson LE, Murray JA (2003 թ․ օգոստոս). «Dermatitis herpetiformis». Int. J. Dermatol. 42 (8): 588–600. doi:10.1046/j.1365-4362.2003.01804.x. PMID 12890100.
- ↑ 46,0 46,1 Tersigni C, Castellani R, de Waure C, Fattorossi A, De Spirito M, Gasbarrini A, Scambia G, Di Simone N (2014). «Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms». Human Reproduction Update. 20 (4): 582–93. doi:10.1093/humupd/dmu007. PMID 24619876.
- ↑ Ferguson A, Hutton MM, Maxwell JD, Murray D (1970). «Adult coeliac disease in hyposplenic patients». Lancet. 1 (7639): 163–4. doi:10.1016/S0140-6736(70)90405-8. PMID 4189238.
- ↑ Kupfer SS, Jabri B (2012). «Pathophysiology of celiac disease». Gastrointest Endosc Clin N Am (Review). 22 (4): 639–60. doi:10.1016/j.giec.2012.07.003. PMC 3872820. PMID 23083984. «Gluten comprises two different protein types, gliadins and glutenins, capable of triggering disease.»
- ↑ 49,0 49,1 49,2 49,3 Biesiekierski, Jessica R (2017). «What is gluten?». Journal of Gastroenterology and Hepatology. 32: 78–81. doi:10.1111/jgh.13703. PMID 28244676. «Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as "gluten." Derivatives of these grains such as triticale and malt and other ancient wheat varieties such as spelt and kamut also contain gluten. The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease.»
- ↑ 50,0 50,1 50,2 50,3 Kupper C (2005). «Dietary guidelines and implementation for celiac disease». Gastroenterology. 128 (4 Suppl 1): S121–7. doi:10.1053/j.gastro.2005.02.024. PMID 15825119.
- ↑ 51,0 51,1 Penagini F, Dilillo D, Meneghin F, Mameli C, Fabiano V, Zuccotti GV (2013 թ․ նոյեմբերի 18). «Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet». Nutrients. 5 (11): 4553–65. doi:10.3390/nu5114553. PMC 3847748. PMID 24253052.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 52,0 52,1 de Souza MC, Deschênes ME, Laurencelle S, Godet P, Roy CC, Djilali-Saiah I (2016). «Pure Oats as Part of the Canadian Gluten-Free Diet in Celiac Disease: The Need to Revisit the Issue». Can J Gastroenterol Hepatol (Review). 2016: 1–8. doi:10.1155/2016/1576360. PMC 4904650. PMID 27446824.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 53,0 53,1 Haboubi NY, Taylor S, Jones S (2006 թ․ հոկտեմբեր). «Coeliac disease and oats: a systematic review». Postgrad Med J (Review). 82 (972): 672–8. doi:10.1136/pgmj.2006.045443. PMC 2653911. PMID 17068278.
- ↑ Gallagher, Eimear (2009). Gluten-free Food Science and Technology. Published by John Wiley and Sons. էջ 320. ISBN 978-1-4051-5915-9. Արխիվացված օրիգինալից 2009 թ․ հունիսի 17-ին.
- ↑ «The Gluten Connection». Health Canada. 2009 թ․ մայիս. Արխիվացված օրիգինալից 2017 թ․ հուլիսի 5-ին. Վերցված է 2013 թ․ հոկտեմբերի 1-ին.
- ↑ Pinto-Sánchez MI, Verdu EF, Liu E, Bercik P, Green PH, Murray JA, Guandalini S, Moayyedi P (2016 թ․ հունվար). «Gluten Introduction to Infant Feeding and Risk of Celiac Disease: Systematic Review and Meta-Analysis». The Journal of Pediatrics. 168: 132–43.e3. doi:10.1016/j.jpeds.2015.09.032. PMID 26500108.
- ↑ Ierodiakonou D, Garcia-Larsen V, Logan A, Groome A, Cunha S, Chivinge J, Robinson Z, Geoghegan N, Jarrold K, Reeves T, Tagiyeva-Milne N, Nurmatov U, Trivella M, Leonardi-Bee J, Boyle RJ (2016 թ․ սեպտեմբեր). «Timing of Allergenic Food Introduction to the Infant Diet and Risk of Allergic or Autoimmune Disease: A Systematic Review and Meta-analysis». JAMA. 316 (11): 1181–1192. doi:10.1001/jama.2016.12623. hdl:10044/1/40479. PMID 27654604.
- ↑ Akobeng AK, Ramanan AV, Buchan I, Heller RF (2006 թ․ հունվար). «Effect of breast feeding on risk of coeliac disease: a systematic review and meta-analysis of observational studies». Archives of Disease in Childhood. 91 (1): 39–43. doi:10.1136/adc.2005.082016. PMC 2083075. PMID 16287899.
- ↑ Lionetti E, Castellaneta S, Francavilla R, Pulvirenti A, Tonutti E, Amarri S, Barbato M, Barbera C, Barera G, Bellantoni A, Castellano E, Guariso G, Limongelli MG, Pellegrino S, Polloni C, Ughi C, Zuin G, Fasano A, Catassi C (2014 թ․ հոկտեմբեր). «Introduction of gluten, HLA status, and the risk of celiac disease in children». The New England Journal of Medicine (comparative study). 371 (14): 1295–303. doi:10.1056/NEJMoa1400697. hdl:2318/155238. PMID 25271602.
- ↑ Longmore, Murray (2014). Oxford handbook of Clinical Medicine. Oxford University Press. էջ 280. ISBN 9780199609628.
- ↑ 61,0 61,1 61,2 Hadithi M, von Blomberg BM, Crusius JB, Bloemena E, Kostense PJ, Meijer JW, Mulder CJ, Stehouwer CD, Peña AS (2007). «Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease». Ann. Intern. Med. 147 (5): 294–302. doi:10.7326/0003-4819-147-5-200709040-00003. PMID 17785484.
- ↑ Jores RD, Frau F, Cucca F, Grazia Clemente M, Orrù S, Rais M, De Virgiliis S, Congia M (2007). «HLA-DQB1*0201 homozygosis predisposes to severe intestinal damage in celiac disease». Scand. J. Gastroenterol. 42 (1): 48–53. doi:10.1080/00365520600789859. PMID 17190762.
- ↑ Karell K, Louka AS, Moodie SJ, Ascher H, Clot F, Greco L, Ciclitira PJ, Sollid LM, Partanen J (2003). «HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease». Hum. Immunol. 64 (4): 469–77. doi:10.1016/S0198-8859(03)00027-2. PMID 12651074.
- ↑ Michalski JP, McCombs CC, Arai T, Elston RC, Cao T, McCarthy CF, Stevens FM (1996). «HLA-DR, DQ genotypes of celiac disease patients and healthy subjects from the West of Ireland». Tissue Antigens. 47 (2): 127–33. doi:10.1111/j.1399-0039.1996.tb02525.x. PMID 8851726.
- ↑ Kaur G, Sarkar N, Bhatnagar S, Kumar S, Rapthap CC, Bhan MK, Mehra NK (2002). «Pediatric celiac disease in India is associated with multiple DR3-DQ2 haplotypes». Hum. Immunol. 63 (8): 677–82. doi:10.1016/S0198-8859(02)00413-5. PMID 12121676.
- ↑ Layrisse Z, Guedez Y, Domínguez E, Paz N, Montagnani S, Matos M, Herrera F, Ogando V, Balbas O, Rodríguez-Larralde A (2001). «Extended HLA haplotypes in a Carib Amerindian population: the Yucpa of the Perija Range». Hum Immunol. 62 (9): 992–1000. doi:10.1016/S0198-8859(01)00297-X. PMID 11543901.
- ↑ 67,0 67,1 Dubois PC, Trynka G, Franke L, Hunt KA, Romanos J, Curtotti A, Zhernakova A, Heap GA, Adány R, Aromaa A, Bardella MT, van den Berg LH, Bockett NA, de la Concha EG, Dema B, Fehrmann RS, Fernández-Arquero M, Fiatal S, Grandone E, Green PM, Groen HJ, Gwilliam R, Houwen RH, Hunt SE, Kaukinen K, Kelleher D, Korponay-Szabo I, Kurppa K, MacMathuna P, Mäki M, Mazzilli MC, McCann OT, Mearin ML, Mein CA, Mirza MM, Mistry V, Mora B, Morley KI, Mulder CJ, Murray JA, Núñez C, Oosterom E, Ophoff RA, Polanco I, Peltonen L, Platteel M, Rybak A, Salomaa V, Schweizer JJ, Sperandeo MP, Tack GJ, Turner G, Veldink JH, Verbeek WH, Weersma RK, Wolters VM, Urcelay E, Cukrowska B, Greco L, Neuhausen SL, McManus R, Barisani D, Deloukas P, Barrett JC, Saavalainen P, Wijmenga C, van Heel DA (2010). «Multiple common variants for celiac disease influencing immune gene expression». Nature Genetics. 42 (4): 295–302. doi:10.1038/ng.543. PMC 2847618. PMID 20190752.
- ↑ Walcher, Dwain N.; Kretchmer, Norman (1981). Food, nutrition, and evolution: food as an environmental factor in the genesis of human variability. Papers presented at the International Congress of the International Organization for the Study of Human Development, Masson Pub. USA. էջեր 179–199. ISBN 978-0-89352-158-5.
- ↑ Catassi, Carlo (2005). «Where Is Celiac Disease Coming From and Why?». Journal of Pediatric Gastroenterology & Nutrition. 40 (3): 279–282. doi:10.1097/01.MPG.0000151650.03929.D5. PMID 15735480.
- ↑ Zhernakova A, Elbers CC, Ferwerda B, Romanos J, Trynka G, Dubois PC, de Kovel CG, Franke L, Oosting M, Barisani D, Bardella MT, Joosten LA, Saavalainen P, van Heel DA, Catassi C, Netea MG, Wijmenga C (2010). «Evolutionary and functional analysis of celiac risk loci reveals SH2B3 as a protective factor against bacterial infection». American Journal of Human Genetics. 86 (6): 970–7. doi:10.1016/j.ajhg.2010.05.004. PMC 3032060. PMID 20560212.
- ↑ Green PH, Cellier C (2007). «Celiac disease». N. Engl. J. Med. 357 (17): 1731–43. doi:10.1056/NEJMra071600. PMID 17960014.
- ↑ Lammers KM, Lu R, Brownley J, Lu B, Gerard C, Thomas K, Rallabhandi P, Shea-Donohue T, Tamiz A, Alkan S, Netzel-Arnett S, Antalis T, Vogel SN, Fasano A (2008). «Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3». Gastroenterology. 135 (1): 194–204.e3. doi:10.1053/j.gastro.2008.03.023. PMC 2653457. PMID 18485912.
- ↑ 73,0 73,1 Qiao SW, Bergseng E, Molberg Ø, և այլք: (2004 թ․ օգոստոս). «Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion». J. Immunol. 173 (3): 1757–62. doi:10.4049/jimmunol.173.3.1757. PMID 15265905.
- ↑ Shan L, Qiao SW, Arentz-Hansen H, Molberg Ø, Gray GM, Sollid LM, Khosla C (2005). «Identification and analysis of multivalent proteolytically resistant peptides from gluten: implications for celiac sprue». J. Proteome Res. 4 (5): 1732–41. doi:10.1021/pr050173t. PMC 1343496. PMID 16212427.
- ↑ 75,0 75,1 Skovbjerg H, Norén O, Anthonsen D, Moller J, Sjöström H (2002). «Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease». Scand J Gastroenterol. 37 (7): 812–7. doi:10.1080/713786534. PMID 12190095.
- ↑ Fleckenstein B, Molberg Ø, Qiao SW, Schmid DG, von der Mülbe F, Elgstøen K, Jung G, Sollid LM (2002). «Gliadin T cell epitope selection by tissue transglutaminase in celiac disease. Role of enzyme specificity and pH influence on the transamidation versus deamidation process». J Biol Chem. 277 (37): 34109–34116. doi:10.1074/jbc.M204521200. PMID 12093810.
- ↑ Koning F, Schuppan D, Cerf-Bensussan N, Sollid LM (2005 թ․ հունիս). «Pathomechanisms in celiac disease». Best Practice & Research. Clinical Gastroenterology. 19 (3): 373–387. doi:10.1016/j.bpg.2005.02.003. ISSN 1521-6918. PMID 15925843.
- ↑ Mowat AM (2003). «Coeliac disease – a meeting point for genetics, immunology, and protein chemistry». Lancet. 361 (9365): 1290–1292. doi:10.1016/S0140-6736(03)12989-3. PMID 12699968.
- ↑ Dewar D, Pereira SP, Ciclitira PJ (2004). «The pathogenesis of coeliac disease». Int J Biochem Cell Biol. 36 (1): 17–24. doi:10.1016/S1357-2725(03)00239-5. PMID 14592529.
- ↑ Kaukinen K, Peräaho M, Collin P, Partanen J, Woolley N, Kaartinen T, Nuutinen T, Halttunen T, Mäki M, Korponay-Szabo I (2005). «Small-bowel mucosal tranglutaminase 2-specific IgA deposits in coeliac disease without villous atrophy: A Prospective and radmonized clinical study». Scand J Gastroenterol. 40 (5): 564–572. doi:10.1080/00365520510023422. PMID 16036509.
- ↑ Salmi TT, Collin P, Korponay-Szabó IR, Laurila K, Partanen J, Huhtala H, Király R, Lorand L, Reunala T, Mäki M, Kaukinen K (2006). «Endomysial antibody-negative coeliac disease: clinical characteristics and intestinal autoantibody deposits». Gut. 55 (12): 1746–53. doi:10.1136/gut.2005.071514. PMC 1856451. PMID 16571636.
- ↑ Londei M, Ciacci C, Ricciardelli I, Vacca L, Quaratino S, Maiuri L (2005). «Gliadin as a stimulator of innate responses in celiac disease». Mol Immunol. 42 (8): 913–918. doi:10.1016/j.molimm.2004.12.005. PMID 15829281.
- ↑ Zanoni G, Navone R, Lunardi C, Tridente G, Bason C, Sivori S, Beri R, Dolcino M, Valletta E, Corrocher R, Puccetti A (2006). «In celiac disease, a subset of autoantibodies against transglutaminase binds toll-like receptor 4 and induces activation of monocytes». PLOS Med. 3 (9): e358. doi:10.1371/journal.pmed.0030358. PMC 1569884. PMID 16984219.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Salim AF, Phillips AD, Farthing MJ (1990). «Pathogenesis of gut virus infection». Baillière's Clinical Gastroenterology. 4 (3): 593–607. doi:10.1016/0950-3528(90)90051-H. PMID 1962725.
- ↑ «Celiac disease: A review». BCMJ. 43 (7): 390–395. 2001 թ․ սեպտեմբեր. Արխիվացված է օրիգինալից 2014 թ․ փետրվարի 22-ին. Վերցված է 2014 թ․ փետրվարի 15-ին.
- ↑ 86,0 86,1 86,2 86,3 van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). «Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review». JAMA. 303 (17): 1738–46. doi:10.1001/jama.2010.549. PMID 20442390. «Most studies used similar histological criteria for diagnosing celiac disease (Marsh grade ≥III), but the level of damage may vary across populations. Only 4 studies presented the proportion of patients in whom only partial villous atrophy was found (Marsh grade of IIIA), which ranged from 4% to 100%. The presence of positive serum antibodies has been shown to correlate with the degree of villous atrophy, and patients with celiac disease who have less severe histological damage may have seronegative findings. This could be important, especially in primary care, in which levels of mucosal damage may be lower, and consequently, more patients with celiac disease may be missed.»
- ↑ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (2000). «Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease». Am. J. Gastroenterol. 95 (5): 1253–57. PMID 10811336.
- ↑ Korponay-Szabó IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J, Kovács JB, Mäki M, Hansson T (2003). «Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency». Gut. 52 (11): 1567–71. doi:10.1136/gut.52.11.1567. PMC 1773847. PMID 14570724.
- ↑ 89,0 89,1 Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, Hoffenberg EJ, Horvath K, Murray JA, Pivor M, Seidman EG (2005). «Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition». J. Pediatr. Gastroenterol. Nutr. 40 (1): 1–19. doi:10.1097/00005176-200501000-00001. PMID 15625418. S2CID 14805217.
- ↑ 90,0 90,1 Hill ID (2005 թ․ ապրիլ). «What are the sensitivity and specificity of serologic tests for celiac disease? Do sensitivity and specificity vary in different populations?» (PDF). Gastroenterology. 128 (4 Suppl 1): S25–32. doi:10.1053/j.gastro.2005.02.012. PMID 15825123. Արխիվացված (PDF) օրիգինալից 2007 թ․ ապրիլի 14-ին.
- ↑ Nandiwada SL, Tebo AE (2013 թ․ ապրիլ). «Testing for antireticulin antibodies in patients with celiac disease is obsolete: a review of recommendations for serologic screening and the literature». Clin. Vaccine Immunol. 20 (4): 447–51. doi:10.1128/CVI.00568-12. PMC 3623418. PMID 23365209.
- ↑ Wong RC, Steele RH, Reeves GE, Wilson RJ, Pink A, Adelstein S (2003). «Antibody and genetic testing in coeliac disease». Pathology. 35 (4): 285–304. doi:10.1080/00313020307527. PMID 12959764.
- ↑ Fagoonee S, De Luca L, De Angelis C, Castelli A, Rizzetto M, Pellicano R (2009 թ․ մարտ). «Anti-Saccharomyces cerevisiae as unusual antibodies in autoimmune hepatitis». Minerva Gastroenterologica e Dietologica. 55 (1): 37–40. PMID 19212306.
- ↑ Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, Cabanne A, Boerr LA, Valero J, Kogan Z, Mauriño E, Bai JC (1998). «Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement». Gastrointestinal Endoscopy. 47 (3): 223–29. doi:10.1016/S0016-5107(98)70317-7. PMID 9580349.
- ↑ Mee AS, Burke M, Vallon AG, Newman J, Cotton PB (1985). «Small bowel biopsy for malabsorption: comparison of the diagnostic adequacy of endoscopic forceps and capsule biopsy specimens». The BMJ. 291 (6498): 769–72. doi:10.1136/bmj.291.6498.769. PMC 1417146. PMID 3929934.
- ↑ Redondo-Cerezo E, Sánchez-Capilla AD, De La Torre-Rubio P, De Teresa J (2014 թ․ նոյեմբեր). «Wireless capsule endoscopy: Perspectives beyond gastrointestinal bleeding». World J. Gastroenterol. 20 (42): 15664–73. doi:10.3748/wjg.v20.i42.15664. PMC 4229531. PMID 25400450.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Marsh MN (1992). «Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue')». Gastroenterology. 102 (1): 330–54. doi:10.1016/0016-5085(92)91819-p. PMID 1727768.
- ↑ Corazza GR, Villanacci V (2005 թ․ հունիսի 1). «Coeliac disease». J. Clin. Pathol. 58 (6): 573–74. doi:10.1136/jcp.2004.023978. PMC 1770677. PMID 15917404.
- ↑ Oberhuber G, Granditsch G, Vogelsang H (1999 թ․ հոկտեմբեր). «The histopathology of coeliac disease: time for a standardized report scheme for pathologists». Eur. J. Gastroenterol. Hepatol. 11 (10): 1185–94. doi:10.1097/00042737-199910000-00019. PMID 10524652.
- ↑ Corazza GR, Villanacci V, Zambelli C, Milione M, Luinetti O, Vindigni C, Chioda C, Albarello L, Bartolini D, Donato F (2007). «Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease». Clin. Gastroenterol. Hepatol. 5 (7): 838–43. doi:10.1016/j.cgh.2007.03.019. PMID 17544877.
- ↑ Ontiveros N, Hardy MY, Cabrera-Chavez F (2015). «Assessing of Celiac Disease and Nonceliac Gluten Sensitivity». Gastroenterology Research and Practice (Review). 2015: 1–13. doi:10.1155/2015/723954. PMC 4429206. PMID 26064097.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Genuis SJ, Lobo RA (2014). «Gluten sensitivity presenting as a neuropsychiatric disorder». Gastroenterol Res Pract (Review). 2014: 293206. doi:10.1155/2014/293206. PMC 3944951. PMID 24693281.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C (2013 թ․ հունվար). «The Oslo definitions for coeliac disease and related terms». Gut. 62 (1): 43–52. doi:10.1136/gutjnl-2011-301346. PMC 3440559. PMID 22345659.
- ↑ Elli L, Roncoroni L, Bardella MT (2015 թ․ հուլիս). «Non-celiac gluten sensitivity: Time for sifting the grain». World J Gastroenterol (Review). 21 (27): 8221–6. doi:10.3748/wjg.v21.i27.8221. PMC 4507091. PMID 26217073.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Fasano A, Sapone A, Zevallos V, Schuppan D (2015 թ․ մայիս). «Nonceliac gluten sensitivity». Gastroenterology (Review). 148 (6): 1195–204. doi:10.1053/j.gastro.2014.12.049. PMID 25583468.
- ↑ 106,0 106,1 Castillo NE, Theethira TG, Leffler DA (2015 թ․ փետրվար). «The present and the future in the diagnosis and management of celiac disease». Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ↑ 107,0 107,1 107,2 107,3 107,4 Levy J, Bernstein L, Silber N (2014 թ․ դեկտեմբեր). «Celiac disease: an immune dysregulation syndrome». Current Problems in Pediatric and Adolescent Health Care (Review). 44 (11): 324–7. doi:10.1016/j.cppeds.2014.10.002. PMID 25499458. «Initially, reduced levels of lactase and sucrase activities might necessitate further dietary restrictions until the villi have healed and those sugars are better tolerated.»
- ↑ 108,0 108,1 108,2 108,3 Montalto M, Gallo A, Ojetti V, Gasbarrini A (2013). «Fructose, trehalose and sorbitol malabsorption» (PDF). European Review for Medical and Pharmacological Sciences (Review). 17 Suppl 2 (Suppl 2): 26–9. PMID 24443064. Արխիվացված (PDF) օրիգինալից 2016 թ․ ապրիլի 12-ին.
- ↑ 109,0 109,1 Leffler DA, Green PH, Fasano A (2015 թ․ հոկտեմբեր). «Extraintestinal manifestations of coeliac disease». Nature Reviews. Gastroenterology & Hepatology (Review). 12 (10): 561–71. doi:10.1038/nrgastro.2015.131. PMID 26260366. S2CID 15561525.
- ↑ 110,0 110,1 110,2 110,3 110,4 110,5 110,6 110,7 110,8 Woodward J (2016 թ․ օգոստոսի 3). «Improving outcomes of refractory celiac disease - current and emerging treatment strategies». Clinical and Experimental Gastroenterology (Review). 9: 225–36. doi:10.2147/ceg.s87200. PMC 4976763. PMID 27536154.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 111,0 111,1 111,2 Berni Canani R, Pezzella V, Amoroso A, Cozzolino T, Di Scala C, Passariello A (2016 թ․ մարտ). «Diagnosing and Treating Intolerance to Carbohydrates in Children». Nutrients. 8 (3): 157. doi:10.3390/nu8030157. PMC 4808885. PMID 26978392.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ 112,0 112,1 112,2 García-Manzanares A, Lucendo AJ (2011 թ․ ապրիլ). «Nutritional and dietary aspects of celiac disease». Nutrition in Clinical Practice (Review). 26 (2): 163–73. doi:10.1177/0884533611399773. PMID 21447770.
- ↑ 113,0 113,1 113,2 113,3 Green PH, Jabri B (2003 թ․ օգոստոս). «Coeliac disease». Lancet (Review). 362 (9381): 383–91. doi:10.1016/S0140-6736(03)14027-5. PMID 12907013. S2CID 39188931.
- ↑ Volta U, Caio G, Tovoli F, De Giorgio R (2013 թ․ սեպտեմբեր). «Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness». Cellular & Molecular Immunology (Review). 10 (5): 383–92. doi:10.1038/cmi.2013.28. PMC 4003198. PMID 23934026.
- ↑ National Institute for Health and Clinical Excellence. Clinical guideline 53: Chronic fatigue syndrome/myalgic encephalomyelitis. London, 2007.
- ↑ Murch S, Jenkins H, Auth M, Bremner R, Butt A, France S, Furman M, Gillett P, Kiparissi F, Lawson M, McLain B, Morris MA, Sleet S, Thorpe M (2013 թ․ հոկտեմբեր). «Joint BSPGHAN and Coeliac UK guidelines for the diagnosis and management of coeliac disease in children». Archives of Disease in Childhood. 98 (10): 806–11. doi:10.1136/archdischild-2013-303996. PMID 23986560. S2CID 30417933.
- ↑ Han Y, Chen W, Li P, Ye J (2015). «Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis». Medicine (Baltimore) (Meta-Analysis). 94 (38): e1612. doi:10.1097/MD.0000000000001612. PMC 4635766. PMID 26402826.
- ↑ 118,0 118,1 Ciaccio EJ, Lewis SK, Biviano AB, Iyer V, Garan H, Green PH (2017). «Cardiovascular involvement in celiac disease». World J Cardiol (Review). 9 (8): 652–666. doi:10.4330/wjc.v9.i8.652. PMC 5583538. PMID 28932354.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Treem WR (2004). «Emerging concepts in celiac disease». Curr Opin Pediatr. 16 (5): 552–9. doi:10.1097/01.mop.0000142347.74135.73. PMID 15367850. S2CID 20221260.
- ↑ Lee AR, Ng DL, Zivin J, Green PH (2007). «Economic burden of a gluten-free diet» (PDF). J Hum Nutr Diet. 20 (5): 423–30. CiteSeerX 10.1.1.662.8399. doi:10.1111/j.1365-277X.2007.00763.x. PMID 17845376. Արխիվացված է օրիգինալից (PDF) 2015 թ․ հունիսի 24-ին. Վերցված է 2018 թ․ փետրվարի 9-ին.
- ↑ Troncone R, Ivarsson A, Szajewska H, Mearin ML (2008). «Review article: future research on coeliac disease – a position report from the European multistakeholder platform on coeliac disease (CDEUSSA)». Aliment. Pharmacol. Ther. 27 (11): 1030–43. doi:10.1111/j.1365-2036.2008.03668.x. PMID 18315588.
- ↑ 122,0 122,1 Akobeng AK, Thomas AG (2008 թ․ հունիս). «Systematic review: tolerable amount of gluten for people with coeliac disease». Aliment. Pharmacol. Ther. 27 (11): 1044–52. doi:10.1111/j.1365-2036.2008.03669.x. PMID 18315587.
- ↑ «Gluten-free food». Directorate-General for Health and Consumers. Արխիվացված օրիգինալից 2015 թ․ հուլիսի 23-ին. Վերցված է 2015 թ․ հուլիսի 25-ին.
- ↑ «What is Gluten-Free? FDA Has an Answer». Food and Drug Administration. 2013 թ․ օգոստոսի 2. Արխիվացված օրիգինալից 2013 թ․ օգոստոսի 4-ին. Վերցված է 2013 թ․ օգոստոսի 2-ին. «As one of the criteria for using the claim 'gluten-free,' FDA is setting a gluten limit of less than 20 ppm (parts per million) in foods that carry this label. This is the lowest level that can be consistently detected in foods using valid scientific analytical tools. Also, most people with celiac disease can tolerate foods with very small amounts of gluten. This level is consistent with those set by other countries and international bodies that set food safety standards.»
- ↑ Section 206 of the Food Allergen Labeling and Consumer Protection Act of 2004, Title II of Կաղապար:USStatute
- ↑ Կաղապար:USFR (5 August 2013). Codified at Կաղապար:USCFR.
- ↑ «Current Official Standards». FAO/WHO. Արխիվացված է օրիգինալից 2011 թ․ հունիսի 4-ին.
- ↑ Anderson, Jane. «Certified Gluten-Free Products: What Does Gluten-Free Certification Mean For Consumers?». About.com. Արխիվացված օրիգինալից 2014 թ․ ապրիլի 12-ին. Վերցված է 2014 թ․ մարտի 4-ին.
- ↑ Burger JP, de Brouwer B, IntHout J, Wahab PJ, Tummers M, Drenth JP (2017 թ․ ապրիլ). «Systematic review with meta-analysis: Dietary adherence influences normalization of health-related quality of life in coeliac disease». Clinical Nutrition. 36 (2): 399–406. doi:10.1016/j.clnu.2016.04.021. PMID 27179800.
- ↑ Mulder CJ, van Wanrooij RL, Bakker SF, Wierdsma N, Bouma G (2013). «Gluten-free diet in gluten-related disorders». Dig. Dis. (Review). 31 (1): 57–62. doi:10.1159/000347180. PMID 23797124. S2CID 14124370.
- ↑ 131,0 131,1 131,2 Lebwohl B, Ludvigsson JF, Green PH (2015 թ․ հոկտեմբեր). «Celiac disease and non-celiac gluten sensitivity». BMJ. 351: h4347. doi:10.1136/bmj.h4347. PMC 4596973. PMID 26438584.
- ↑ Rewers M (2005 թ․ ապրիլ). «Epidemiology of celiac disease: what are the prevalence, incidence, and progression of celiac disease?» (PDF). Gastroenterology. 128 (4 Suppl 1): S47–51. doi:10.1053/j.gastro.2005.02.030. PMID 15825126. Արխիվացված (PDF) օրիգինալից 2007 թ․ ապրիլի 14-ին.
- ↑ Guandalini S, Assiri A (2014 թ․ մարտ). «Celiac disease: a review». JAMA Pediatrics. 168 (3): 272–8. doi:10.1001/jamapediatrics.2013.3858. PMID 24395055.
- ↑ Catassi C, Rätsch IM, Gandolfi L, Pratesi R, Fabiani E, El Asmar R, Frijia M, Bearzi I, Vizzoni L (1999 թ․ օգոստոս). «Why is coeliac disease endemic in the people of the Sahara?». Lancet. 354 (9179): 647–8. doi:10.1016/S0140-6736(99)02609-4. PMID 10466670. S2CID 9242679.
- ↑ «Coeliac Disease - Coeliac Australia». www.coeliac.org.au. Վերցված է 2019 թ․ մայիսի 8-ին.
- ↑ Houlston RS, Ford D (1996). «Genetics of coeliac disease». QJM. 89 (10): 737–43. doi:10.1093/qjmed/89.10.737. PMID 8944229.
- ↑ Buchanan N (1987). Child and Adolescent Health for Practitioners. Williams & Wilkins. էջ 164. ISBN 978-0-86433-015-4.
- ↑ Zipser RD, Farid M, Baisch D, Patel B, Patel D (2005). «Physician awareness of celiac disease: a need for further education». J Gen Intern Med. 20 (7): 644–6. doi:10.1007/s11606-005-0111-7. PMC 1490146. PMID 16050861.
- ↑ 139,0 139,1 Barker JM, Liu E (2008). «Celiac disease: pathophysiology, clinical manifestations, and associated autoimmune conditions». Adv Pediatr. 55: 349–65. doi:10.1016/j.yapd.2008.07.001. PMC 2775561. PMID 19048738.
- ↑ Leeds JS, Hopper AD, Sanders DS (2008). «Coeliac disease». Br Med Bull. 88 (1): 157–70. doi:10.1093/bmb/ldn044. PMID 19073695.
- ↑ 141,0 141,1 Oxentenko, AS; Rubio-Tapia, A (2019 թ․ դեկտեմբեր). «Celiac Disease». Mayo Clinic Proceedings. 94 (12): 2556–2571. doi:10.1016/j.mayocp.2019.02.019. PMID 31806106.
- ↑ 142,0 142,1 142,2 Adams F, translator (1856). «On The Cœliac Affection». The extant works of Aretaeus, The Cappadocian. London: Sydenham Society. էջեր 350–1. Վերցված է 2009 թ․ դեկտեմբերի 12-ին.
{{cite book}}:|last=has generic name (օգնություն) - ↑ 143,0 143,1 Losowsky MS (2008). «A history of coeliac disease». Digestive Diseases. 26 (2): 112–20. doi:10.1159/000116768. PMID 18431060. S2CID 10062937.
- ↑ Kemppainen KM, Lynch KF, Liu E, Lönnrot M, Simell V, Briese T, և այլք: (2017 թ․ մայիս). «Factors That Increase Risk of Celiac Disease Autoimmunity After a Gastrointestinal Infection in Early Life». Clinical Gastroenterology and Hepatology. 15 (5): 694–702.e5. doi:10.1016/j.cgh.2016.10.033. PMC 5576726. PMID 27840181.
- ↑ Verdu EF, Caminero A (2017 թ․ ապրիլ). «How infection can incite sensitivity to food». Science. 356 (6333): 29–30. Bibcode:2017Sci...356...29V. doi:10.1126/science.aan1500. PMID 28385972. S2CID 206659081.
- ↑ Freeman HJ (2013 թ․ նոյեմբեր). «Non-dietary forms of treatment for adult celiac disease». World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 4 (4): 108–12. doi:10.4292/wjgpt.v4.i4.108. PMC 3817285. PMID 24199026.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Vanga RR, Kelly CP (2014 թ․ մայիս). «Novel therapeutic approaches for celiac disease». Discovery Medicine. 17 (95): 285–93. PMID 24882720.
- ↑ 148,0 148,1 Castillo NE, Theethira TG, Leffler DA (2015). «The present and the future in the diagnosis and management of celiac disease». Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ↑ «Innovate Biopharmaceuticals». www.innovatebiopharma.com. Արխիվացված օրիգինալից 2016 թ․ ապրիլի 18-ին. Վերցված է 2016 թ․ ապրիլի 17-ին.
- ↑ 150,0 150,1 Buie T (2013). «The relationship of autism and gluten». Clin Ther (Review). 35 (5): 578–83. doi:10.1016/j.clinthera.2013.04.011. PMID 23688532. «At this time, the studies attempting to treat symptoms of autism with diet have not been sufficient to support the general institution of a gluten-free or other diet for all children with autism.»
- ↑ Marí-Bauset S, Zazpe I, Mari-Sanchis A, Llopis-González A, Morales-Suárez-Varela M (2014 թ․ դեկտեմբեր). «Evidence of the gluten-free and casein-free diet in autism spectrum disorders: a systematic review». J Child Neurol. 29 (12): 1718–27. doi:10.1177/0883073814531330. hdl:10171/37087. PMID 24789114. S2CID 19874518.
- ↑ Millward C, Ferriter M, Calver S, Connell-Jones G (2008). Ferriter M (ed.). «Gluten- and casein-free diets for autistic spectrum disorder». Cochrane Database Syst Rev (2): CD003498. doi:10.1002/14651858.CD003498.pub3. PMC 4164915. PMID 18425890.
- ↑ Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE (2015 թ․ հունիս). «Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders». Best Pract Res Clin Gastroenterol. 29 (3): 477–91. doi:10.1016/j.bpg.2015.04.006. PMID 26060112. «autism spectrum disorders (ASD) have been hypothesized to be associated with NCGS [47,48]. Notably, a gluten- and casein-free diet might have a positive effect in improving hyperactivity and mental confusion in some patients with ASD. This very exciting association between NCGS and ASD deserves further study before conclusions can be firmly drawn»
- ↑ San Mauro I, Garicano E, Collado L, Ciudad MJ (2014 թ․ դեկտեմբեր). «¿Es el gluten el gran agente etiopatogenico de enfermedad en el siglo XXI?» [Is gluten the great etiopathogenic agent of disease in the XXI century?]. Nutr Hosp (Spanish). 30 (6): 1203–10. doi:10.3305/nh.2014.30.6.7866. PMID 25433099.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link)
Արտաքին հղումներ
խմբագրել| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ցելիակիա» հոդվածին։ |