Ածխաջրածիններ
Ածխաջրածիններ, օրգանական միացություններ, կազմված միայն ածխածնի և ջրածնի ատոմներից[1]։ Ածխաջրածինները համարվում են օրգանական քիմիայի բազային միացությունները, բոլոր մնացած միացությունները համարվում են ածխաջրածինների ածանցյալներ։
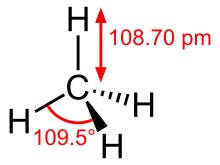
Քանի որ ածխածինն ունի չորս վալենտային էլեկտրոններ, իսկ ջրածինը` մեկ, ապա պարզագույն ածխաջրածինը մեթանն է (CH4):
Որպես կանոն` ածխաջրածինները չեն խառնվում ջրի հետ, քանի որ ածխածնի և ջրածնի ատոմները ունեն գրեթե հավասար էլեկտրաբացասականություններ և կապերը մոլեկուլներում քիչ են բևեռացված։
Դասակարգում
խմբագրելԿախված ածխածնային կմախքի կառուցվածքից ածխաջրածինները բաժանվում են երկու խմբի՝ ացիկլիկ և կարբոցիկլիկ ածխաջրածիններ։
Կախված ածխածին-ածխածին կապի կարգից ացիկլիկները լինում են հագեցած(ալկաններ[2]) և չհագեցած (ալկեններ[3], ալկիններ[4], դիեններ)։ Կարբոցիկլերը լինում են ալիցիկլիկ և արոմատիկ։
| Ացիկլիկ միացություններ (բաց շղթայով) | Կարբոցիկլիկ միացություններ (փակ շղթայով) | ||||
|---|---|---|---|---|---|
| հագեցած | չհագեցած | հագեցած | չհագեցած | ||
| միակի կապով | կրկնակի կապով | եռակի կապով | երկու կրկնակի կապերով | միակի կապով | բենզոլային օղակով |
| ալկաններ | ալկեններ | ալկիններ | դիեններ | ցիկլոալկաններ | արեններ |
Ածխաջրածինների համեմատական աղյուսակ
խմբագրել| Ածխաջրածիններ | Ալկաններ | Ալկեններ | Ալկիններ | Ալկադիեններ | Ցիկլոալկաններ | Արեններ |
|---|---|---|---|---|---|---|
|
Ընդհանուր բանաձև |
CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n | CnH2n-6 |
|
Կառուցվածք |
sp3-հիբրիդացում, 4 էլեկտրոնային ամպերը ուղղված են տետրաեդրի գագաթները 109°28' անկյան տակ, ածխածնային կապի բնույթը՝ σ-կապ | sp2-հիբրիդացում, վալենտային անկյունը 120°, ածխածնային կապի բնույթը՝ π-կապ, lc-c = 0, 134 նմ | sp-հիբրիդացում, հարթ մոլեկուլ (180°), եռակի կապ, lc-c = 0, 120 նմ | sp2-հիբրիդացում, lc-c = 0, 132 նմ – 0, 148 նմ, 2 կամ ավելի π-կապեր | sp2-հիբրիդացում, վալենտային անկյուն՝ մոտավորապես 100°, lc-c = 0, 154 նմ | Բենզոլի մոլեկուլի կառուցվածք (6 р-էլեկտրոն, n = 1), վալենտային անկյուն՝ 120°, lc-c = 0, 140 նմ, հարթ մոլեկուլ (6 π | σ) |
| Ածխածնային շղթայի[5] և օպտիկական | Ածխածնային շղթայի, կրկնակի կապի դիրքի, միջդասային և երկրաչափական | Ածխածնային շղթայի, եռակի կապի դիրքի և միջդասային | Ածխածնային շղթայի, կրկնակի կապի դիրքի, միջդասային և երկրաչափական | Ածխածնային շղթայի, կողային շղթայի, միջդասային, տարածական, երկրաչափական և կոնֆորմացիոն | Կողային շղթայի | |
|
Քիմիական հատկություններ |
տեղակալման, օքսիդացման, ռադիկալային հալոգենացման, այրման, անջատման ռեակցիաներ | Միացման, այրման, օքսիդացման ռեակցիաներ | Միացման, այրման, օքսիդացման ռեակցիաներ | Միացման, օքսիդացման, այրման ռեակցիաներ | Տեղակալման, օքսիդացման, այրման ռեակցիաներ | Էլեկտրոֆիլ տեղակալման, օքսիդացման, այրման ռեակցիաներ |
|
Ֆիզիկական հատկություններ |
CH4 մինչև C4H10 — գազ, C5H12 մինչև C16H34 — հեղուկ, C17H36- ից հետո — պինդ | C2H4 մինչը C4H8 — գազ, C5H10 մինչև C17H34 — հեղուկ, C18H36- ից հետո — պինդ | Նման են ալկեններին | Բութադիեն — գազ (tեռ= −4, 5 °C), իզոպրեն — հեղուկ (tեռ= 36 °C), դիմեթիլբութադիեն - հեղուկ (tեռ= 70 °C), իզոպրենը և այլ դիեններ կարող են առաջացնել կաուչուկ | C3H6 մինչև C4H8 — գազ, C5H10 մինչև C16H32 — հեղուկ, C17H34- ից հետո — պինդ | Բոլորը պինդ կամ հեղուկ նյութեր են |
|
Ստացում |
Ածխաջրածինների հալոգենածանցյալների, սպիրտների, կարբոնիլային միացությունների, չհագեցած ածխաջրածինների վերականգնումից | Ածխաջրածինների, նավթի և բնական գազի կատալիտիկ և բարձրջերմաստիճանային կրեկինգից[6], սպիրտների դեհիդրատացումից, համապատասխան հալոգենածանցյալների դե(հիդրո) հալոգենացումից | Մեթանը ենթարկում են թերմոկրեկինգի, կալցիումի կարբիդի հիդրոլիզից | Դիոլների դեհիդրատացում, ալկանների և ալկենների դեհիդրում | Արոմատիկ ածխաջրածինների հիդրատացում | Նավթի մշակումից, ացետիլենի տրիմերումից |
Պարզագույն ածխաջրածիններ
խմբագրել| Ածխածնի ատոմերի քանակը | Ալկաններ | Ալկեններ | Ալկիններ | Ցիկլոալկաններ | Դիեններ |
|---|---|---|---|---|---|
| 1 | Մեթան | - | - | - | - |
| 2 | Էթան | Էթեն (էթիլեն) | Էթին (ացետիլեն) | – | – |
| 3 | Պրոպան | Պրոպեն | Պրոպին | Ցիկլոպրոպան | Պրոպադիեն |
| 4 | Բութան | Բութեն | Բութին | Ցիկլոբութան | Բութադիեն |
| 5 | Պենտան | Պենտեն | Պենտին | Ցիկլոպենտան | Պենտադիեն |
| 6 | Հեքսան | Հեքսեն | Հեքսին | Ցիկլոհեքսան | Հեքսադիեն |
| 7 | Հեպտան | Հեպտեն | Հեպտին | Ցիկլոհեպտան | Հեպտադիեն |
| 8 | Օկտան | Օկտեն | Օկտին | Ցիկլոօկտան | Օկտադիեն |
| 9 | Նոնան | Նոնեն | Նոնին | Ցիկլոնոնան | Նոնադիեն |
| 10 | Դեկան | Դեկեն | Դեկին | Ցիկլոդեկան | Դեկադիեն |
Ածխածինը այլ տարրերի հետ օրգանական քիմիայում
խմբագրել
| Հիմնական միացություններ | Ունեն մեծ կիրառություն քիմիայում |
| Ակադեմիական հետազոտություններ | Միացություններ, որոնք հայտնի չեն կամ չեն ստացվել |
Ծանոթագրություններ
խմբագրել- ↑ Silberberg, 620
- ↑ Silderberg, 623
- ↑ Silderberg, 628
- ↑ Silderberg, 631
- ↑ Silderberg, 625
- ↑ World Coal, Coal and Electricity, http://www.worldcoal.org/coal/uses-of-coal/coal-electricity/ Արխիվացված 2015-10-22 Wayback Machine, retrieved 07/03/2012
Գրականություն
խմբագրել- Silberberg, Martin. Chemistry։ The Molecular Nature Of Matter and Change. New York։ McGraw-Hill Companies, 2004
Արտաքին հղումներ
խմբագրել| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ածխաջրածիններ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 209)։ |