Էթան
Էթան (լատին․՝ Ethanum), (), օրգանական միացություն, ալկանների հոմոլոգիական շարքի երկրորդ անդամը։ Բնության մեջ հանդիպում է բնական գազի, նավթի և այլ նյութեր բաղադրության մեջ։ Մեթանի և պրոպանի համեմատ ավելի հրդեհավտանգ և պայթյունավտանգ է։ Ունի թմրացնող ազդեցություն, որը թուլացնում է արյան և ջրի լուծելիությունը։
| Էթան | |
|---|---|
 | |
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | Էթան |
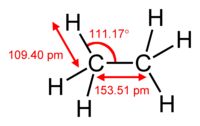
| Քիմիական բանաձև | C₂H₆ |
| Ռացիոնալ բանաձև | |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | գազային |
| Մոլային զանգված | 5,0E−26 կիլոգրամ[1] գ/մոլ |
| Իոնիզացման էներգիա | 1,8E−18 ջոուլ[2] կՋ/մոլ |
| Հալման ջերմաստիճան | −182,8 °C[2] °C |
| Եռման ջերմաստիճան | 184,6 K[3] և −88,6 °C[2] °C |
| Այրման ջերմաստիճան | 152 °C |
| Ինքնաբռնկման ջերմաստիճան | 472 °C |
| Գոյացան էնթալպիա | −83 820 ջոուլ մեկ մոլի համար[3] կՋ/մոլ |
| Քիմիական հատկություններ | |
| Կառուցվածք | |
| Բյուրեղային կառուցվածք | մոլեկուլային |
| Դիպոլ մոմենտ | 0 Կլ·մ[2] |
| Դասակարգում | |
| CAS համար | 74-84-0 |
| PubChem | 6324 |
| EINECS համար | 200-814-8 |
| SMILES | CC |
| ЕС | 200-814-8 |
| RTECS | KH3800000 |
| ChEBI | 6084 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Հատկություններ
խմբագրելՖիզիկական հատկությունները
խմբագրելԷթանը ստանդարտ պայմաններում անգույն, անհոտ, անհամ գազ է։ Մոլային զանգվածը՝ 30 գ/մոլ է։ Հեղուկանում է -182,81 °C-ում և անցնում է գազային վիճակի՝ -88,63 °C-ում։
Քիմիական հատկությունները
խմբագրելՄոլեկուլային ֆորմուլն է (տարածականը՝ )։ Բնորոշ հատկությունն է հալոգենների հետ ընթացող ռեակցիան, որն ընթանում է ջրածնի տեղակալմամբ ազատ շղթայական ռադիկալային մեխանիզմով։ Էթանի ջերմային դեհիդրումից 550-650 °C ընկած հատվածում առաջանում է էթիլեն, իսկ 800 °C և ավելիի դեպքում՝ ացետիլեն (ստացվում է նաև բենզոլ )։ Անմիջական քլորացումից 300-450 °C ջերմաստիճաններում առաջանում է էթիլքլորիդ, նիտրացման ժամանակ՝ նիտրոէթան։
Ֆիզիոլոգիական ազդեցությունը
խմբագրելՀանդիսանում է թույլ նարկոտիկ հատկություններով օժտված նյութ։
Ստացումը
խմբագրելԱրդյունաբերական ստացման եղանակներ
խմբագրելԱրդյունաբերությունում ստանում են նավթից և բնական գազից, որում ըստ ծավալի այն կազմում է 10%։
Լաբորատոր ստացման եղանակներ
խմբագրելԼաբորատորիայում ստանում են մեթիլհալոգենիդներից Վյուրցի եղանակով, նատրիումի ացետատի էլեկտրոլիզից Կոլբեի ռեակցիայի միջոցով, էթիլբրոմիդից Գրինյարի ռեակցիայի միջոցով, էթիլենի հիդրումից(պալադիում կատալիզատորի միջոցով) կամ ացետիլենի հիդրումից(նիկել կատալիզատորի միջոցով)։
Կիրառումը
խմբագրելԷթանը հիմնականում օգտագործում են էթիլենի ստացման համար։
Հետաքրքիր փաստեր
խմբագրելԵնթադրվում է, որ Սատուրնի արբանյակ Տիտանի մակերեսային շերտերում ցածր ջերմաստիճանի պատճառով(-180 °C) գոյություն ունեն հեղուկ մեթան-էթանային խառնուրդի ամբողջ գետեր և լճեր։
Աղբյուրներ
խմբագրել- Тутурин Н. Н., Этан // Энциклопедический словарь Брокгауза и Ефрона։ В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 ETHANE
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 3,0 3,1 3,2 3,3 Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics // J. Chem. Educ. — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Էթան» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 4, էջ 7)։ |
