Ածխաթթու գազ
Ածխաթթվական գազ, CO2 ածխածնի երկօքսիդն է՝ ածխածնի և օրգանական միացությունների այրման վերջնական արդյունքը։
| Ածխաթթու գազ | |
|---|---|
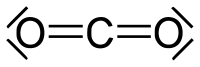 | |
| Քիմիական բանաձև | CO₂ |
| Մոլային զանգված | 7,3E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,9768 գ/մ³, 925 գ/մ³ և 1560 գ/մ³ գ/սմ³ |
| Իոնիզացման էներգիա | 2,2E−18 ջոուլ[2] կՋ/մոլ |
| Սուբլիմացման ջերմաստիճան | −78,5 °C, −109 ℉ և −78,4 °C[2] |
| Գոյացան էնթալպիա | 394 կՋ/մոլ կՋ/մոլ |
| Հալման էնթալպիա | 9,02 կՋ/մոլ կՋ/մոլ |
| Եռման էնթալպիա | 16,7 կՋ/մոլ կՋ/մոլ |
| Գոլորշու ճնշում | 5 724 862,5 Pa |
| Քիմիական հատկություններ | |
| Դիպոլ մոմենտ | 0 Կլ·մ[2] |
| Դասակարգում | |
| CAS համար | 124-38-9 |
| PubChem | 280 |
| EINECS համար | 204-696-9 |
| SMILES | C(=O)=O |
| ЕС | 204-696-9 |
| RTECS | FF6400000 |
| ChEBI | 274 |
| IDLH | 72 000 mg/m³ |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Ածխաթթվական գազի հատկանիշները
խմբագրելԱծխաթթնական գազը անգույն, անհոտ, թույլ թթվահամով, օդից 1,5 անգամ ծանր գազ է։ Այդ պատճառով էլ այն կարելի է հեղուկի նման մի անոթից զգուշորեն տեղափոխել մյուսի մեջ։ Ածխաթթվական գազը կարելի է նաև հեղուկացնել՝ միայն բարձր ճնշման տակ, իսկ մթնոլորտային ճնշման պայմաններում պնդացնել՝ վերածելով «չոր սառույցի», որը ձեզ անպայման ծանոթ է։
Ածխաթթվի աղեր
խմբագրելԱծխաթթվական գազը լուծվում է ջրում՝ առաջացնելով ածխաթթու, որը հիմքերի հետ գոյացնում է աղեր՝ կարբոնատներ և հիդրոկարբոնատներ։ Դրանցից են մեզ բոլորիս լավ հայտնի սոդան` նատրիումի կարբոնատը (Na2CO3), և խմելու սոդան՝ նատրիումի հիդրոկարբոնատը (NaHCO3): Ածխաթթվի մյուս աղը` կալցիումի կարբոնատը (CaCO3)։
Ածխաթթվի առաջացում
խմբագրելԲնության մեջ հանդիպում է հսկայական քանակությամբ և միանգամից 3 ձևով՝ կավճի, կրաքարի և մարմարի։ Այդ ապարների հզոր շերտերը հասնում են մինչև երկրակեղևի խորքերը, որտեղ ստորգետնյա խոր հորիզոնների ջերմությունը քայքայում է կարբոնատները, և անջատվում է ածխաթթվական գազ։ Ժայթքելով երկրակեղևի ճեղքերի և հրաբուխների խառնարանների միջով՝ ածխաթթվական գազը դուրս է գալիս մթնոլորտ։ Մարդկանց և կենդանիների շնչառության, զանազան նյութերի այրման և փտման ժամանակ նույնպես անջատվում է ածխաթթվական գազ։
Ածխաթթու գազ և բնապահպանություն
խմբագրելՄթնոլորտում, հատկապես նրա վերին շերտերում, ածխաթթվական գազի պարունակության չնչին աճն ազդում է Երկրից Տիեզերք ջերմանցման բնական ընթացքի վրա, որի հետևանքով նկատվում է Երկրի միջին ջերմաստիճանի աճի միտում, որն այլ կերպ անվանում են ջերմոցային էֆեկտ։ Վերջինիս դեմ պայքարը ներկայումս լուրջ էկոլոգիական խնդիր է։ Օդում ածխաթթվական գազի քանակի չափավորությունը (մոտավորապես 0,03%) մարդու համար շատ կարևոր է, քանի որ այն թունավոր է։ Այդօրինակ «աղետներից» մեզ փրկում են կանաչ բույսերը, որոնց հիմնական սնունդը ածխաթթվական գազն է, բույսերի տերևները կլանում են ածխաթթվական գազը՝ փոխարենը մեզ տալով այնքան անհրաժեշտ թթվածինը։ Ածխաթթվական գազը հիմնականում օգտագործվում է սննդի արդյունաբերության մեջ՝ գազավորված ըմպելիքներ, փրփրուն գինիներ, պահածոյված սննդամթերք պատրաստելու համար։ Չոր սառույցը հիանալի սառնազդակ է, 2 անգամ ավելի արդյունավետ, քան սովորական սառույցը։ Այն օգտագործվում է շուտ փչացող մթերքները պահպանելու և տեղափոխելու համար։
Արտանետում
խմբագրելԱծխաթթու գազի արտանետման ծավալներն աշխարհում, 2000-2021[3].
Կրակմարիչ
խմբագրելԱծխաթթվական գազը չի այրվում և այրմանը չի նպաստում. այդ հատկության շնորհիվ այն օգտագործվում է հրդեհները մարելու համար։ Կրակմարիչները լիցքավորում են ածխաթթվական գազով կամ նատրիումի հիդրոկարբոնատի լուծույթով։ Այս դեպքում բալոնի վերին մասում ամրացվում է ծծմբական թթվով լցված սրվակ։ Կրակմարիչը գործի դնելիս ծծմբական թթուն խառնվում է նատրիումի հիդրոկարբոնատի հետ։ Փոխազդեցության հետևանքով անջատվում է ածխաթթվական գազ, որը հեղուկի հետ առաջացնում է շիթ և մեծ ճնշման տակ դուրս մղվում կրակմարիչից։ Փրփուրը ծածկում է այրվող առարկայի մակերեսը, մեկուսացնում այն օդի թթվածնից և, այրումը դադարեցնելով, հանգցնում է կրակը։ Ածխաթթվական գազը հայտնաբերել է հոլանդացի քիմիկոս Յա.վան Հելմոնտը 1620 թ-ին։ Կրաքարի վրա հանքային թթու ավելացնելով՝ նա ստացավ նոր «օդ» (գազ), որն անվանեց «անտառային օդ», քանի որ այդ գազը ստացվում էր նաև ծառերի այրումից։ («Գազ» բառը ներմուծել է Հելմոնտը, որը հունարեն նշանակում է քաոս)։ Ածխաթթվական գազի բաղադրությունն առաջինը հաստատել է ֆրանսիացի քիմիկոս Ա.Լ.Լավուազիեն։ Իտալիայի Նեապոլ քաղաքի մոտ գտնվող «Շան քարանձավում» (այնտեղ մտնող շները սատկում են) և Ճավա կղզու «Մահվան հովտում» երկրի ընդերքից դուրս է գալիս ածխաթթվական գազ, որը, օդից ծանր լինելով, կուտակվում է անձավների գետնամերձ մասերում և շնչահեղձ անում այնտեղ հայտնված կենդանիներին։ Այդ առումով ստորգետնյա բոլոր խոր անձավները վտանգավոր են. այդպիսի տեղերում հայտնվելիս պետք է զգուշանալ ածխաթթվական գազի պատահական կուտակումներից։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 carbon dioxide
- ↑ 2,0 2,1 2,2 2,3 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ «Annual CO2 emissions worldwide 1940-2020». Statista (անգլերեն). Վերցված է 2022 թ․ հոկտեմբերի 16-ին.
Արտաքին հղումներ
խմբագրել| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ածխաթթու գազ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 208)։ |