Ածխաթթու
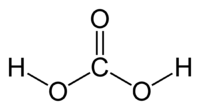
Ածխաթթու, H2CO3, երկհիմն թույլ թթու։ Մաքուր ածխաթթուն կայուն է –30 °C–ում։ Սովորական պայմաններում անկայուն են անգամ ածխաթթվի նոսր լուծույթները, որոնք ստացվում են ածխածնի երկօքսիդը ջրում լուծելիս։ Ածխաթթուն առաջացնում է թթու և չեզոք աղեր՝ բիկարբոնատներ և կարբոնատներ։ Մետաածխաթթվից (H2CO3) բացի հայտնի է նաև օրթոածխաթթուն՝ C(OH)4, որը, սակայն, ազատ վիճակում գոյություն չուևի։ Հայտնի են միայն նրա էսթերները՝ Շ(0&)4։ Ածխաթթվի նոսր լուծույթներն օգտագործվում են որպես զովացուցիչ ջրեր։ Լայն կիրառում ունեն ածխաթթվի աղերը։
| Ածխաթթու | |
|---|---|
  | |
| Ընդհանուր տեղեկություններ | |
| Քիմիական բանաձև | H2CO3 |
| Ֆիզիկական հատկություններ | |
| Արտաքին տեսք | անգույն լուծույթ |
| Մոլային զանգված | 62,03 գ/մոլ |
| Խտություն | 1,668 գ/սմ³ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | 344 °C |
| Սուբլիմացման ջերմաստիճան | ? = ? |
| Հալման էնթալպիա | −623 կՋ/մոլ կՋ/մոլ |
| Քիմիական հատկություններ | |
| pKa | 6,37[1] |
| Դասակարգում | |
| CAS համար | 463-79-6 |
| PubChem | 767, 3614646, 22639876 |
| EINECS համար | 610-295-3 |
| SMILES | C(=O)(O)O |
| ЕС | 610-295-3 |
| ChEBI | 747 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Ֆիզիկական հատկություններ
խմբագրելԱշխաթթուն ազատ վիճակում գոյություն չունի, այն գտնվում է ջրային լուծույթների մեջ՝ ածխածնի երկօքսիդի հետ հավասարակշռված։ Ածխաթթվի մոլեկուլն ունի հարթ կառուցվածք։ Ածխածնի կենտրոնական ատոմն ունի sp² հիբրիդացում։ Գազային վիճակում մաքուր ածխաթթուների վարքագիծը հետազոտվել է 2011 թվականին ավստրիացի քիմիկոսների կողմից[2]։
Քիմիական հատկություններ
խմբագրելՀավասարակշռումը ջրային լուծույթներում և թթուներում
խմբագրելՋրային լուծույթներում ածխածնի երկօքսիդի հիդրատով ածխաթթվի հավասարումը հետևյալն է՝
- , հավասարակշռության հաստատունը 25 °C ջերմաստիճանում :
Ուղիղ ռեակցիայի արագությունը 0,039 с−1, հակադարձը՝ 23 с−1: Լուծվող ածխածնի երկօքսիդի հիդրատն իր հերթին, հավասար է գազային ածխաթթու գազի հետ՝
- :
Այս հավասարակշռությունը փոփոխվում է ճիշտ այնպես, ինչպես ջերմաստիճանը բարձրանում է, իսկ ճնշման բարձրացմանը զուգահեռ տեղաշարժվում է դեեպի ձախ։ Ածխաթթունենթարկվում է հիդրոիզի, ստեղծելով թթվային միջավայր։
- , թթվայնության հաստատուն 25 °C ջերմաստիճանում՝ :
Այնուամենայնիվ, գործնական հաշվարկների համար ակնհայտ թթվայնության կայունությունը հաճախ օգտագործվում է, հաշվի առնելով ածխաթթուների հավասարակշռությունը ածխածնի երկօքսիդի հիդրատ՝
Հիդրոկարբոնատ-իոնը ենթարկվում է հիդրոլիզի՝
- , թթվայնության հաստատուն 25 °C -ի դեպքում՝ :
Այսպիսով, ածխաթթու պարունակող լուծույթներում ստեղծվում է համալիր հավասարակշռության համակարգ, որն կարելի է ներկայացնել հետեւյալ կերպ.
- :
- , где L = 0,034 մոլ/լ — CO2 լուծելիությունը ջրի մեջ՝ հատուկ պայմաններում։
Տեսակներ
խմբագրելՀեղուկի ջերմաստիճանի բարձրացումը եւ / կամ ածխածնի երկօքսիդի մասնակի ճնշման նվազումը, հավասարակշռությունը փոխում է դեպի ածխաթթու `ջրի եւ ածխածնի երկօքսիդի տարրալուծում։ Լուծույթի եռման ժամանակ ածխաթթում ամբողջությամբ տրոհվում է՝
- :
Հիմքերի և աղերի հետ փոխազդեցություն
խմբագրելՀիմքերի և թթուների հետ փոխազդեցության ռեակցիայի օրինակներ են՝
- (կոնց.)
- (ջրիկ.)
Կարբոնատների հետ փոխազդեցությունից առաջանում են հիդրոկարբոնատներ՝
Ծանոթագրություններ
խմբագրել- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ International first: Gas-phase carbonic acid isolated
Գրականություն
խմբագրել- Лидин Р. А., Молочко В. А., Андреева Л. Л., ISBN 978-5-358-01303-2։
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ածխաթթու» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 208)։ |