Նատրիումի հիդրոկարբոնատ
Սոդա կամ Նատրիումի հիդրոկարբոնատ, ածխաթթվի նատրիումական աղերի տեխնիկական և կենցաղային անվանումը։ Տարբերում են կալցինացված սոդա՝ Na2CO3, խմելու սոդա՝ NаНСО3, և բյուրեղական սոդա՝ Na2CO3 •nH2O(n= 10, 7 և 1)։ Նատրիումի հիդրօքսիդին՝ NaOH, տեխնիկայում և կենցաղում անվանում են կաուստիկ սոդա։
| Նատրիումի հիդրոկարբոնատ | |
|---|---|
 | |
 | |
 | |
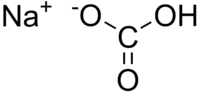
| Քիմիական բանաձև | NaHCO₃ |
| Մոլային զանգված | 1,4E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 2,159 գ/սմ³ գ/սմ³ |
| Կազմալուծման ջերմաստիճան | 60 °C |
| Քիմիական հատկություններ | |
| Դասակարգում | |
| CAS համար | 144-55-8 |
| PubChem | 516892 |
| EINECS համար | 205-633-8 |
| SMILES | C(=O)(O)[O-].[Na+] |
| ЕС | 205-633-8 |
| RTECS | VZ0950000 |
| ChEBI | 8609 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Օգտագործում խմբագրել
Սոդան հայտնի է հին ժամանակներից, հին եգիպտացիները լճերի ջրերից ստացվող սոդան օգտագործում Էին ապակի ստանալու համար և որպես լվացող միջոց։ Հռոմեացիներն այդ նպատակներով օգտագործում Էին արևելքից բերվող «նիտրումը»՝ բնական սոդան։ Բնության մեջ սոդան հանդիպում է տրոն՝ Na2CO3 •NaHCO3 •2H2O, սոդա (նատրիտ, նատրոն)՝ Na2CO3 •10H2O և թերմոնատրիտ Na2CO3 H2O հանքանյութերի ձևով։ Զգալի քանակներով սոդա են պարունակում Նատրոն (Տանզանիա), Սերլս (Ամերիկայի Միացյալ Նահանգներ) լճերը, նաև անդրբայկալյան և Արևմտյան Սիբիրի սոդային լճերը։ Արդյունաբերական նշանակություն ունի Գրին-Ռիվերի (Վերջինիա) Էոցենային շերտում հայտնաբերված տրոնը։
Անջուր սոդա՝ Na2CO3 խմբագրել
Անջուր սոդա՝ Na2CO3, անգույն բյուրեղական նյութ է, խտությունը՝ 2532,6 կգ/մ3, հալման ջերմաստիճանը՝ 853 °C։ Լավ է լուծվում ջրում (100 գրամում 20 °С ջերմաստիճանում 21,5 գրամ, 100 °C ջերմաստիճանում՝ 45,6 գրամ)։ Լուծույթները հիմնային են։ Լուծույթից անջատվում է Na2CO3 •10H2O (կենցաղային անվանումը՝ լվացքի սոդա), որը 32,017 °C-ից բարձր տաքացնելիս փոխարկվում է Na2CO3 •7H2O-ի, իսկ 35,27 °C-ից բարձր՝ Na2CO3 •H2O-ի։
Նատրիումի հիդրոկարբոնատ՝ NaHCO3 խմբագրել
Նատրիումի հիդրոկարբոնատը՝ NaHCO3, սպիտակ բյուրեղական նյութ է, 50 °C-ից բարձր տաքացնելիս սկսում է քայքայվել (100-150 °C-ում՝ ամբողջությամբ)՝ առաջացնելով Na2CO3։ Լավ է լուծվում ջրում, լուծույթը թույլ հիմնային է։
Արդյունաբերական ստացում խմբագրել
Սոդայի ստացման արդյունաբերական առաջին եղանակը առաջարկել է ֆրանսիացի քիմիկոս Ն․ Լեբլանը (1887-1889 թվականներ)․ Na2SO4, ածխածին(C) և կալցիումի կարբոնատ (СаСO3) պարունակող խառնուրդը բովում են (1000°С), ստացված սոդան լուծում ջրում, որտեղից նստեցված Na2CO3 •H2O-ն շիկացնելով կալցինացնում։ Ավելի շահավետ է բելգիացի քիմիկոս է․ Սոլվեի առաջարկած (1861 թվական) ամոնիակային եղանակը, որը սոդայի ստացման հիմնական արդյունաբերական եղանակն է։ Որպես հումք օգտագործում են նատրիումի քլորիդի լուծույթը և կրաքարը։ Օգտագործվում է նաև ամոնիակ, որը չի ծախսվում։ Սոդայի ստացումն իրականացվում է հետևյալ սխեմայով՝
- CaCO3=CaO + CO2,
- CO2+ 2NH3+ H2O=(NH4)2CO3,
- (NH4)2CO3+H2O+CO2=2NH4HCO3,
- NH4HCO3+ NaCl=NaHCO3 + NH4Cl,
- 2NaHCO3=Na2CO3+ CO2+H2O
Ամոնիումի քլորիդի լուծույթը կրակաթի հետ տաքացնելով՝ ստանում են ամոնիակ, որն օգտագործվում է նորից։
Կիրառություն խմբագրել
Սոդան քիմիական արդյունաբերության հիմնական նյութերից է։ Օգտագործվում է ապակու, օճառի, թղթի և ներկարարական արտադրություններում, շոգեկաթսաներում (ջուրը փափկացնելու համար)։ Նատրիումի հիդրոկարբոնատն օգտագործվում է զովացուցիչ ըմպելիքների, հացի, թխվածքի արտադրության և բժշկության (ստամոքսահյութի թթվայնությունը իջեցնելու, կոկորդը ողողելու, մաշկի լվացումների համար են) մեջ։
Ծանոթագրություններ խմբագրել
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Նատրիումի հիդրոկարբոնատ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 10, էջ 488)։ |