Ացետոն
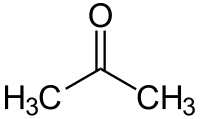
Ացետոն (դիմեթիլ կետոն, պրոպանոն-2)[8], օրգանական միացություն, որն ունի CH3—C(O)—CH3 բանաձևը, հագեցած կետոնների պարզագույն ներկայացուցիչը։
| Ացետոն | |
|---|---|
 | |
 | |
 | |
| Քիմիական բանաձև | C₃H₆O |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 9,6E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 0,7902 գ/սմ³[2] գ/սմ³ |
| Մակերեսային լարվածություն | (20 °C)։ 23,7 մ Ն/մ |
| Իոնիզացման էներգիա | 1,6E−18 ջոուլ և 1,6E−18 ջոուլ[3] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | −140 ℉, −95 °C[4], −94 °C[5] և −94,8 °C[3] °C |
| Եռման ջերմաստիճան | 133 ℉, 56 °C[4] և 56,05 °C[3] °C |
| Այրման ջերմաստիճան | 0 ℉ |
| Ինքնաբռնկման ջերմաստիճան | 465 °C[6] |
| Կրիտիկական ճնշում | 46.385 մթն. |
| Գոյացան էնթալպիա | −247,7 կՋ/մոլ |
| Հալման էնթալպիա | 5,69 կՋ/մոլ կՋ/մոլ |
| Եռման էնթալպիա | 29,1 կՋ/մոլ |
| Գոլորշու ճնշում | 23 998 Pa |
| Քիմիական հատկություններ | |
| pKa | 19,16 ± 0,04[7] |
| Բեկման ցուցիչ | 1,3588 |
| Դիպոլ մոմենտ | 9,6E−30 Կլ·մ[3] |
| Դասակարգում | |
| CAS համար | 67-64-1 |
| PubChem | 180 |
| EINECS համար | 200-662-2 |
| SMILES | CC(=O)C |
| ЕС | 200-662-2 |
| RTECS | AL3150000 |
| ChEBI | 175 |
| IDLH | 5950 mg/m³ |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |

Իր անվանումն ացետոնը ստացել է լատիներեն acetum (քացախ) բառից։ Դա պայմանավորված է նրանով, որ ացետոնը հնում ստանում էին ացետատներից, որից հետո, ացետոնից ստանում էին սառցային քացախաթթու։
Հայտնագործում
խմբագրելՊարզագույն, միևնույն ժամանակ կարևորագույն կետոններից մեկը՝ ացետոնը, առաջին անգամ հայտնաբերվել է 1595 թվականին գերմանացի գիտնական Անդրեաս Լիբիավուսի կողմից՝ կապարի ացետատի չոր թորման արդյունքում։ Սակայն ճիշտ պարզաբանել քիմիական հատկություները և դասակարգել հաջողվեց միայն 1832 թվականին Ժան-Բատիստ Դյումային և Յուստուս ֆոն Լիբիխին։ Մինչև 1914 թվականը ացետոնը ստանում էին փայտի կոկսացմամբ, սակայն մեծացած պահանջարքի պատճառով մշակվեցին ստացման նոր մեթոդներ։
Ֆիզիկական հատկություններ
խմբագրելԱցետոնը անգույն, շարժուն, հեշտ ցնդող հեղուկ է, բնութագրական սուր հոտով։ Ցանկացած հարաբերությամբ խառնվում է ջրի, էթիլ սպիրտի, մեթիլ սպիրտի, բենզոլի, դիէթիլ եթերի, և շատ այլ էստերների հետ և այլն։
Հիմնական թերմոդինամիկական բնոոթագրեր[9]
- մակերևութային ակտիվություն՝ (20 °C)։ 23,7 մՆ/մ
- առաջացման ստանդարտ էնթալպիան ΔH (298 Կ)՝ −247,7 կՋ/մոլ
- առաջացման ստանդարտ էնդրոպիան S (298 Կ)՝ 200 Ջ/մոլ·Կ
- ստանդարտ մոլյար ջերմունակություն՝ 125 Ջ/մոլ·Կ
- հալման էնթալպիան ΔHհալ՝ 5,69 կՋ/մոլ
- եռման էնթալպիան ΔHեռ՝ 29,1 կՋ/մոլ
- այրման ջերմաքանակը Qp՝ 1829,4 կՋ/մոլ
- կրիտիկական ճնշում՝ 4,7 ՄՊա
- կրիտիկական խտություն՝ 0,273 գ/սմ3
Թերմոքիմիական բնութագրեր
- օդում բռնկման ջերմաստիճանը[10]՝ −17,778 °C (-18 °C)
- օդում ինքնաբռնկման ջերմաստիճանը՝ 465 °C
- պայթյունավտանգ կոնցենտրացիաների սահմանները՝ 2,6-12,8 %
Օպտիկական հատկություններ
- բեկման ցուցիչը՝ ( D-նատրիումի գծի համար)։
- 1,3591՝ (20 °C)
- 1,3588՝ (25 °C)
- դիսոցման աստիճանը՝ pKa = 20 (20 °C, ջուր)
- դիէլեկտրիկ թափանցելիությունը՝ (20 °C)։ 20,9
- մոլեկուլի դիպոլ մոմոնտը՝ (20 °C)։ 2,84 Դեբայ
Քիմիական հատկություններ
Ացետոնը հանդիսանում է առավել ակտիվ կետոններից, և տալիս է բիսուլֆիդային միացություն։
Հիմքերի ազդեցության տակ, մտնում է ալդոլ կոնդեսացիայի մեջ՝ առաջացնելով դիացետո սպիրտ։
վերականգնումը ցինկով մինչև պինակոին
բարձր ջերմաստիճանում (700 °C) առաջանում է կետեն
հեշտությամբ կապում է ցիանոջրածին առաջացնելով ացետոն ցիանհիդրին
Ացետոնում ջրածնի ատոմները տեղակալվում են հալոգենների ատոմներով։ Քլորի և յոդի ազդեցությամբ հիմնային միջավայրում առաջացնում է քլորոֆորմ և յոդֆորմ։
Ստացում
խմբագրելԱցետոնի համաշխարհային արտադրությունը հասնում է 6,9 տոննա տարեկան (2012 թ. տվյալներով) և շարունակում է աճել, արդյունաբերությունում ստացվում է ուղղակի ճանապարհով կամ անուղղակի պրոպենից։
Կումոլային եղանակ
Ացետոնի հիմնական մասը ստանում են կումոլային եղանակով երբ ացետոնը հանդիսանում է բենզոլի և ֆենոլի հետ միասին պրոդուկտ։
Ստացումը իզոպրոպիլենից
Պրոպենի օքսիդացումից
Կիրառում
խմբագրելՀանդիսանում է բազմաթիվ կարևոր քիմիական միացությունների սիթեզի համար. քացախաթթվի անհիդրիդի, կետենի, դիացետոնային սպիրտի, մեզիտիլի օքսիդի, մեթիլիզոբութիլկետոն, մեթիլմետակրիլատ, դիֆենիլպրոպոն և այլն։ Օրինակ՝
Վերջինի լայն կիրառություն ունի պոլիկարբոնատների, պոլիուրիտանների և էպօքսիդային խեժերի սինթեզում։ Հանդիսանում է նաև բևեռային լուծիչ, զգալիորեն տարբերվում է անվտանգության տեսանկյունից՝ բենզինից, սկիպիդարից և կերոսինից։ Մասնավորապես օգտագործվում է։
- լաքերի արտադրությունում
- պայթուցիկ նյութերի արտադրությունում
- դեանյութերի սինթեզ
- սոսինձներում որպես լուծիչ
- տարբեր արտադրական պրոցեսներում, որպես լվացող միջոց
- գործիքների լվացնելու միջոց
Առանց ացետոնի հնարավոր չէ պատկերացնել, ացետիլենի տեղափողությունը անհնար է պատկերացնել, հայտնի է, որ մաքուր ացետիլենը պայթյունավտանգ է։ Դրա համար էլ օգտագործվում է, պարզ տարաներ մեջը լցված ացետոն։ 1 լիտր ացետոնում լուծվում է մինչև 250 լիտր ացետիլեն։ Օգտագործվում է նաև բազմաթիվ բուսական միջոցների էքստրակցիայի համար։
Լաբորատոր կիրառումը
Օրգանական քիմիայում կիրառվում է, որպես ապրոտոն պոլյար լուծիչ ալկիլացման ռեակցիաների համար։
Ալյումինի ալկոհոլատի ներկայությամբ սպիրտների օքսիդցման համար
Օգտագործվում է սառցե բաղնիքների պատրաստման համար ՛՛չոր սառույցի՛՛ և հեղուկ ամոնյակի հետ միախառնելիս (մինչև −78 °C)։ Լաբորատորիայում օգտագործում են ամանները լվանալու, շուտ չորացնելու համար շնորհիվ ցածր գնի, քիչ տոկսիկության և հեշտ ցնդելու հետևանքով։ Լաբորատոր պայմաններում մաքրելու համար ացետոնը թորում են նոսր կալիումի պերմանգանատի լուծույթի ներկայությամբ։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 acetone
- ↑ 2,0 2,1 http://hbcponline.com/faces/contents/InteractiveTable.xhtml
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 4,0 4,1 4,2 4,3 ACETONE
- ↑ 5,0 5,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0087.html
- ↑ Chiang Y., Kresge A. J., Tang Y. S., Wirz J. The pKa and keto-enol equilibrium constant of acetone in aqueous solution // J. Am. Chem. Soc. / P. J. Stang — ACS, 1984. — Vol. 106, Iss. 2. — P. 460—462. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA00314A055
- ↑ Химическая энциклопедия. — М: Советская энциклопедия, 1988. — Т. 1. — С. 230. — 625 с.
- ↑ Рабинович В. А., Хавин З. Я. Краткий химический справочник: Справ. изд. / Под ред. Потехина А. А., Ефимова А. И.. — Издание 3-е, переработанное и дополненное. — Л.:: Химия, 1991. — С. 328-329. — 432 с. — ISBN 5-7245-0703-X.
- ↑ Lewis R.J. Sax's Dangerous Properties of Industrial Materials. — 11ed.. — Wiley-interscience, 2004. — С. 22-23
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ացետոն» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 2, էջ 159)։ |