Բորի մոդել
Բորի մոդել, Բորի ատոմի մոդել, Ռեզերֆորդ-Բորի մոդել, ատոմի կիսադասական մոդել, որն առաջարկել է Նիլս Բորը 1913 թվականին։ Որպես հիմք նա վերցրել է ատոմի մոլորակային մոդելը, որը առաջ էր քաշել Ռեզերֆորդը։ Սակայն, դասական էլեկտրադինամիկայի տեսանկյունից, Ռեզերֆորդի մոդելում էլեկտրոնը, որը պտտվում էր միջուկի շուրջը պետք է անընդհատ ճառագայթեր և շատ արագ կորցնելով էներգիան՝ ընկներ միջուկի վրա։ Այս խնդիրը հաղթահարելու համար Բորը առաջ քաշեց մի ենթադրություն, ըստ որի՝ էլեկտրոնները ատոմում կարող են շարժվել միայն որոշակի (ստացիոնար) ուղեծրերով, որոնցում գտնվելով նրանք չեն ճառագայթում, իսկ ճառագայթումը կամ կլանումը տեղի է ունենում միայն մի ուղեծրից մյուսին անցնելիս։ Ընդ որում հիմանական են համարվում այն ուղեծրերը, որոնցում էլեկտրոնի իմպուլսի մոմենտը բազմապատիկ է Պլանկի հաստատունին՝ բաժանած 2π-ի՝
։
Օգտագործելով այս ենթադրությունը և դասական մեխանիկայի օրենքները, մասնավորապես, պտտվող էլեկտրոնի վրա ազդող ուժերի՝ միջուկի կողմից էլեկտրոնի ձգման ուժի և կենտրոնախույս ուժի հավասարությունը, ենթադրությունը հիմնական ուղեծրային շառավղի և այդ ուղեծրում գտնվող էլեկտրոնի էներգիայի համար ստացավ հետևյալ առնչությունը ՝
Այստեղ -ն էլեկտրոնի զանգվածն է, Z-ը՝ միջուկում պրոտոններրի քանակը, -ն՝ դիէլեկտրիկական հաստատունը ( =0.085·10−11 Ֆ/մ), e-ն՝ էլեկտրոնի լիցքը։ Կիրառելով Շրեդինգերի հավասարումը, հենց այսպիսի արտահայտություն կարելի է ստանալ էներգիայի համար՝ լուծելով կենտրոնական կուլոնյան դաշտում էլեկտրոնի շարժման վերաբերյալ խնդիրը։
Ջրածնի ատոմում առաջին ուղեծրի R0=ao=5, 2917720859(36)·10−11 մ շառավիղը այժմ կոչվում է Բորի շառավիղ կամ երկարության ատոմային միավոր և լայնորեն օգտագործվում է ժամանակակից ֆիզիկայում։ Առաջին ուղեծրի 13.6 էՎ էներգիան ջրածնի ատոմի իոնացման էներգիան է։
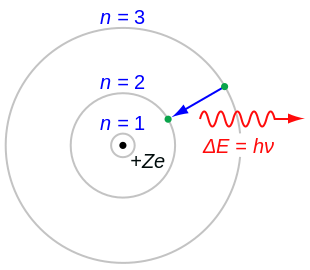
Ջրածնի ատոմի արձակած կամ կլանած ճառագայթման հաճախության հաշվարկը
խմբագրելՕգտվելով Բորի երկրորդ կանխադրույթից և -րդ ստացիոնար վիճակում ունեցած էներգիայի բանաձևից բխում է -ից ստացիոնար ուղեծիր անցնելիս արձակված կամ կլանված ճառագայթման հաճախության բանաձևը՝
,
որտեղ -ն վերջնական էներգիական մակարդակն է, -ն՝ սկզբնական։
Քանի որ ֆոտոնի էներգիան
է, ֆոտոնի ալիքի երկարությունը կտրվի
բանաձևով։ Այն հայտնի է Ռիդբերգի բանաձև անունով։ R-ը կոչվում է Ռիդբերգի հաստատուն. բնական միավորներով այն հավասար է կամ ։
Օգտվելով այս բանաձևից, n=1-ից n=2 ստացիոնար ուղեծիր անցնելիս արձակված ճառագայթման հաճախության համար կստանանք 2.4675·1015 Հց արժեքը։
Բորի կիսադասական տեսությունը
խմբագրելՏեսությունը հիմնված է Բորի երկու դրույթների վրա.
- Ատոմը կարող է գտնվել միայն հատուկ ստացիոնար կամ քվանտային վիճակներում, որոնցից յուրաքանչյուրին համապատասխանում է որոշակի էներգիա։ Ստացիոնար վիճակում ատոմը չի ճառագայթում էլեկտրամագնիսական ալիքներ։
- Ատոմի կողմից էներգիայի ճառագայթումը և կլանումը տեղի է ունենում մի ստացիոնար վիճակից մյուս վիճակին թռիչքաձև անցումների դեպքում։ Այդ դեպում տեղի ունեն երկու առնչություններ.
- , որտեղ -ը ճառագայթված (կլանված) էներգիան է, , n_2</math> -ը՝ քվանտային վիճակների համարները։ Սպեկտրասկոպիայում -ը և -ը կոչվում են մակարդակներ։
- Իմպուլսի մոմենտի քվանտացման պայմանը՝
Հետագայում ելնելով անշարժ միջուկի շուրջը կուլոնյան ձգողության ուժի ազդեցությմաբ ստացիոնար ուղեծրով էլեկտրոնի շրջանաձև շարժման մասին դասական ֆիզիկայի պատկերացումներից՝ ստացիոնար ուղեծրերի շառավղի և այդ ուղեծրերի վրա էլեկտրոնի էներգիայի համար Բորը ստացավ հետևյալ արտահայտությունները՝
մ –Բորի շառավիղ։
-Ռիդբերգի էներգիական հաստատուն (թիվը հավասար է 13, 6 էվ)։
Զոմմերֆելդ-Դիրակի հավասարումը
խմբագրելԱտոմային միջուկի շուրջ էլեկտրոնի շարժումը դասական մեխանիկայի շրջանակներում կարելի է դիտարկել որպես ադիաբադ ինվարիանտով բնութագրվող գծային տատանակ (օսցիլյատոր), որը իրեննից ներկայացնում է էլիպսի մակերեսը (ընդհանրացված կոորդինատներով)՝
որտեղ -ն ընդհանրացված իմպուլսն և էլեկտրոնի կոորդինատներն են, -ն էներգիան է, -ն ՝ հաճախությունը։ Քվանտային տեսությունը հաստատում է, որ կորով սահմանափակված մակերեսը փուլում՝ շարժման մեկ պարբերության համար, հավասար է Պլանկի h հաստատունին բազմապատիկ ամբողջ թվի (Դեբայ, 1913 թ.)։ նուրբ կառուցվածքի հաստատունի դիտարկման տեսանկյունից՝ առավել հետաքրքիր է հանդիսանում ատոմի միջուկի դաշտում ռելյատիվիստական էլեկտրոնի շարժումը, երբ նրա զանգվածը կախված է շարժման արագությունից։ Այդ դեպքում մենք ունենք երկու քվանտային պայման՝
,
որտեղ - ը որոշում է էլեկտրոնի էլիպսային ուղեծրի գլխավոր կիսաառանցքը ( ), իսկ -ն նրա կիզակետային պարամետրն է՝
, ։
Այս դեպքում Զոմմերֆելդը էներգիայի համար ստացավ հետևյալ արտահայտությունը՝
որտեղ -ը Ռիդբերգի հաստատունն է, իսկ -ը ատոմի կարգաթիվն է (ջրածնի համար =1 )։ լրացուցիչ անդամը բնութագրում է ջրածնանման ատոմների սպեկտրալային մակարդակների առավել բարակ ճեղքերը, իսկ դրանց թիվը որոշվում է քվանտային թվով։ Այսպիսով, սպեկտրալային գծերը իրենցից ներկայացնում են ավելի նուրբ գծերի համակարգ, որոնք համապատասխանում են բարձր ( ) և ցածր ( ) վիճակի մակարդակների միջև անցումներին։ Հենց սա էլ իրենից ներկայացնում է սպեկտրյալային գծերի նուրբ կառուցվածքը։
Բորի տեսության առավելությունները
խմբագրել- Բացատրեց ջրածնանման ատոմների էներգետիկ վիճակների դիսկրետությունը։
- Բորի տեսությունը մոտեցավ ներատոմային պրոցեսների բացատրությանը։ Այն դարձավ ատոմի առաջին կիսաքվանտային տեսությունը։
- Բորի տեսության էվրիստիկական նշանակությունը կայանում է ստացիոնար վիճակների գոյության և նրանց միջև թռիչքաձև անցումների մասին համարձակ ենթադրությանը մեջ։
Բորի տեսության թերությունները
խմբագրել- Բորի տեսությունը չկարողացավ բացատրել սպեկտրյալային գծերի ինտենսիվությունը։
- Այս տեսությունը ճիշտ է միայն ջրածնանման ատոմների համար և չի գործում Մենդելեևի պարբերական աղյուսակում ջրածնանման ատոմներին հաջորդող ատոմների համար։
- Բորի տեսությունը տրամաբանորեն հակասական է. այն չի հանդիսանում ո′չ դասական, ո′չ քվանտային։ Նրա հիմքում ընկած երկու հավասարումների համակարգում հավասարումներից մեկը՝ էլեկտրոնի շարժման հավասարումը, դասական է, իսկ մյուսը՝ ուղեծրերի քվանտացման հավասարումը՝ քվանտային։
Բորի տեսությունը բավարար չափով ընդհանուր և հաջորդական չէ։ Այդ իսկ պատճառով այն հետագայում փոխարինվեց ժամանակակից քվանտային մեխանիկայով, որը հիմնված էր առավել ընդհանրական և չհակասող ելակետային դրույթների վրա։ Այժմ հայտնի է, որ Բորի պոստուլատները հանդիսանում են առավել ընդհանրական քվանտային օրենքների հետևանք։ Սակայն, քվանտացման օրենքները լայնորեն օգտագործվում են նաև մեր օրերում, որպես մոտավոր հարաբերակցություններ։ Նրանց ճշտությունը հաճախ լինում է շատ բարձր։
Գրականություն
խմբագրելБорн М. Атомная физика, 2-е изд., М.։Мир, 1967.- 493с
Ծանոթագրություններ
խմբագրել- ↑ Akhlesh Lakhtakia (Ed.); Salpeter, Edwin E. (1996). «Models and Modelers of Hydrogen». American Journal of Physics. World Scientific. 65 (9): 933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691. ISBN 981-02-2302-1.



