Օրթոֆոսֆորական թթու
Օրթոֆոսֆորական թթու (ֆոսֆորական թթու), միջին ուժի անօրգանական թթու է, քիմիական բանաձևն է H3PO4, այն ստանդարտ պայմաններում իրենից ներկայացնում է անգույն հիդրոսկոպիկ բյուրեղներ։ 213 °C ջերմաստրճանից բարձր ջերմաստիճանում փոխակերպվում է պիրոֆոսֆորական թթվի H4P2O7։ Ջրում լավ լուծելի է։ Հիմնականում օրթոֆոսֆորական թթու անվանում են 85%-անոց ջրային լուծույթը(անգույն, անհոտ հեղուկ է)։ Լուծվում է նաև էթանոլում և այլ լուծիչներում։
| Օրթոֆոսֆորական թթու | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | օրթոֆոսֆորական թթու |
| Ավանդական անվանում | ֆոսֆորական թթու |
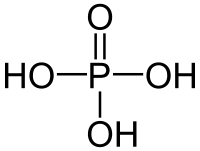
| Քիմիական բանաձև | H₃PO₄ |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 1,6E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,685 գ/սմ3 գ/սմ³ |
| Դինամիկ մածուցիկություն | 2,4-9,4 Պա/վ Պա/վ |
| Հալման ջերմաստիճան | 108 ± 1 ℉[2], 20 °C[3] և 42,4 °C[4] °C |
| Եռման ջերմաստիճան | 415 ± 1 ℉[2] և 407 °C[4] °C |
| Գոլորշու ճնշում | 0,03 ± 0,01 mm Hg[2] |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 548 գ/100 մլ գ/100 մլ |
| pKa | 1,97 ± 0,01[5] և 2,12[6] |
| Դասակարգում | |
| CAS համար | 7664-38-2 |
| PubChem | 1004, 22486802 |
| EINECS համար | 231-633-2 |
| SMILES | OP(=O)(O)O |
| ЕС | 231-633-2 |
| RTECS | TB6300000 |
| ChEBI | 979 |
| IDLH | 1000 ± 1000 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |

Ստացում
խմբագրելՖոսֆորական թթու հիմնականում ստանում են կալցիումի ֆոսֆատից։
Կարելի է ստանալ ֆոսֆորի պենտաքլորիդի(PCl5) հիդրոլիզից։
Կարելի է ստանալ ջրի և ֆոսֆորի հնգավալենտ օքսիդի փոխազդեցությունից։
Հատկություններ
խմբագրելՖոսֆորական թթուն եռահիմն, միջին ուժի թթու է։ Այն երբ փոխազդում է ավելի ուժեղ թթվի հետ, ցուցաբերում է երկդիմի հատկություն։ Օրթոֆոսֆորական թթուն կամ իր լուծելի աղերը կարելի է հայտնաբերել դրանց վրա արծաթի նիտրատի լուծույթով ազդելով։ Նկատվում է դեղին գույնի նստվածք (չեզոք միջավայր)։
Ֆոսֆատներ
խմբագրելՖոսֆորական թթվի աղերը կոչվում են ֆոսֆատներ։ Կարող են առաջանալ է դիհիդրոֆոսֆատ, հիդրոֆոսֆատ և ֆոսֆատ։
Հիմնականում դիհիդրոֆոսֆատները լուծելի են, իսկ հիդրոֆոսֆատներն ու ֆոսֆատները քիչ լուծելի են։ Դիհիդրոֆոսֆատները և հիդրոֆոսֆատները կարող են փոխակերպվել հետևյալ ուրվագրով։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 Phosphoric acid
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 http://www.cdc.gov/niosh/npg/npgd0506.html
- ↑ 3,0 3,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ 4,0 4,1 4,2 4,3 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Kumler W. D., Eiler J. J. The Acid Strength of Mono and Diesters of Phosphoric Acid. The n-Alkyl Esters from Methyl to Butyl, the Esters of Biological Importance, and the Natural Guanidine Phosphoric Acids // J. Am. Chem. Soc. / P. J. Stang — ACS, 1943. — Vol. 65, Iss. 12. — P. 2355—2361. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01252A028
- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
Գրականություն
խմբագրել- Карапетьянц, Михаил Христофорович|Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.։ Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Օրթոֆոսֆորական թթու» հոդվածին։ |