Ացետիլեն
Ացետիլեն (էթին), չհագեցած ածխաջրածին C2H2։ Ածխածնի ատոմների մեջ կա եռակի կապ։ Ալկինների շարքի առաջին անդամն է։
| Ացետիլեն | |
|---|---|
 | |
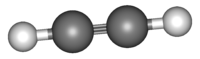 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | էթին |
| Ավանդական անվանում | ացետիլեն |
| Քիմիական բանաձև | C2H2 |
| Մոլային զանգված | 4,3E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,0896 գ/լ գ/սմ³ |
| Իոնիզացման էներգիա | 1,8E−18 ջոուլ[2][3] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | −80,8 °C և −80,75 °C[3] °C |
| Սուբլիմացման ջերմաստիճան | −83,9 °C[2] |
| Եռման ջերմաստիճան | −83,6 °C և −84,72 °C[3] °C |
| Ինքնաբռնկման ջերմաստիճան | 305 °C[4] |
| Եռյակ կետ | -80,55 °С |
| Գոյացան էնթալպիա | −227,4 կՋ/մոլ կՋ/մոլ |
| Գոլորշու ճնշում | 4 478 565 Pa[2] |
| Քիմիական հատկություններ | |
| pKa | 25 |
| Դիպոլ մոմենտ | 0 Կլ·մ[3] |
| Դասակարգում | |
| CAS համար | 74-86-2 |
| PubChem | 6326 |
| EINECS համար | 200-816-9 |
| SMILES | C#C |
| ЕС | 200-816-9 |
| RTECS | AO9600000 |
| ChEBI | 6086 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Ֆիզիկական հատկություններ
խմբագրելՆորմալ պայմաններում անգույն, օդից թեթև գազ է։ Մաքուր 100 % ացետիլենը հոտ չունի։ Տեխնիկական ացետիլենը պարունակում է խառնուրդներ, որոնք ացետիլենին տալիս են յուրահատուկ հոտ։ Ջրում քիչ լուծելի է, լավ է լուծվում ացետոնում։ Եռման ջերմաստիճանը −83,6 °C: Եռյակ կետը՝ −80,55 °C ջերմաստիճանի, 961,5 մմ սնդիկի սյան ճնշման պայմաններում։ Կրիտիկական կետը՝ 35,18 °C ջերմաստիճանում, 61,1 մթնոլորտ ճնշման պայմաններում։ Ացետիլենի հետ շփման մեջ մտնելիս պետք է շատ զգույշ լինել։ Հարվածից կարող է պայթել մինչև 500 °C տաքացնելիս կամ սենյակային ջերմաստիճանում մինչև 1,4 մթնոլորտ սեղմելիս։ Ացետիլենը օդում կարող է այրվել ամենափոքր կայծից, անգամ ձեռքերի շփումից։ Ացետիլենի տեղափոխման համար օգտագործում են հատուկ տարաներ։ Ացետիլեն հայտնաբերվել է Ուրան և Նեպտուն մոլորակներում։
Քիմիական հատկություններ
խմբագրելԱցետիլենին բնորոշ է միացման ռեակցիաները։
- HC≡CH + Cl2 -> СlСН=СНСl
Ացետիլենը ջրի հետ, սնդիկի աղերի ներկայությամբ, փոխազդելիս, առաջանում է քացախալդեհիդ(Կուչերովի ռեակցիա)։ Թթվածնի միջավայրում այրելիս, ջերմաստիճանը հասնում է մինչև 3150 °C: Ացետիլենը ունակ է պոլիմերվելու։ Բացի այդ ացետիլենում ջրածնի ատոմները պրոտոնի տեսքով կարող են առանձնանալ։
Ացետիլենի հիմնական քիմիական ռեակցիաները
խմբագրել
Ացետիլենը գունազրկում է բրոմաջուրը և կալիումի պերմանգանատի ջրային լուծույթը։ Փոխազդում է պղնձի և արծաթի միարժեք աղերի ամոնիակային լուծույթների հետ, առաջացնելով քիչ լուծելի, պայթուցիկ ացետիլենիդներ։
Ստացում
խմբագրելԼաբորատորիայում ացետիլեն ստանում են կալցիումի կարբիդի և ջրի փոխազդեցությունից։
Ստանում են նաև մեթանի դեհիդրումից՝ t>1400 °C
Կիրառություն
խմբագրելԱցետիլենը օգտագործում են՝
- Մետաղների զոդման համար
- Պայթուցիկ նութերի ստացման մեջ
- Տեխնիկական ածխածին ստանալու համար
- Հրթիռային շարժիչներում և այլն։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 Ethyne
- ↑ 2,0 2,1 2,2 2,3 http://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://www.cdc.gov/niosh-rtecs/AB903210.html
Գրականություն
խմբագրել- Миллер С. А. Ацетилен, его свойства, получение и применение. Том 1. — Л.: Химия, 1969. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3 (ռուս.)
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ացետիլեն» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 2, էջ 158)։ |