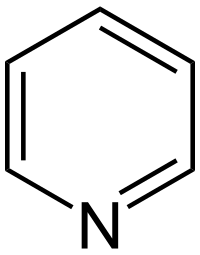
Պիրիդին
Պիրիդին` վեցանդամանի հետերոցիկլիկ օրգանական միացություն, որը պարունակում է մեկ ատոմ ազոտ։ Նրա հոմալոգները և այլ պիրիդինային հիմքեր առաջին անգամ հայտնաբերվել են ոսկորների չոր թորումից ստացվող յուղի մեջ։
| Պիրիդին | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | պիրիդին |
| Ավանդական անվանում | C5H5N |
| Քիմիական բանաձև | C₅H₅N |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | հեղուկ |
| Մոլային զանգված | 1,3E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 0,98 գ/սմ³[2] գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,94 պուազեյլ Պա/վ |
| Իոնիզացման էներգիա | 1,5E−18 ջոուլ[2] և 1,5E−18 ջոուլ[3] կՋ/մոլ |
| Հալման ջերմաստիճան | −44 ℉[2], −42 °C[4] և −41,66 °C[3] °C |
| Եռման ջերմաստիճան | 240 ℉[2] և 115,23 °C[3] °C |
| Այրման ջերմաստիճան | 68 ℉[2] |
| Գոլորշու ճնշում | 2133,16 Pa[2] |
| Քիմիական հատկություններ | |
| Դիպոլ մոմենտ | 7,4E−30 Կլ·մ |
| Դասակարգում | |
| CAS համար | 110-86-1 |
| PubChem | 1049 |
| EINECS համար | 203-809-9 |
| SMILES | C1=CC=NC=C1 |
| ЕС | 203-809-9 |
| RTECS | UR8400000 |
| ChEBI | 1020 |
| IDLH | 3240 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Պիրիդինը անգույն հեղուկ է, բնորոշ անդուր հոտով, խառնվում է ջրի հետ բոլոր հարաբերություններով։ Նա շատ լավ լուծիչ է շատ օրգանկան նյութերի համար։ Նրանում լավ լուծվում են անօրգանական աղերը՝ CuCl2,Cu2Cl2, ZnCl2,HgCl2, AgNO3:
Բացահայտման պատմություն
խմբագրելՊիրիդինը հայտնի էր դեռ ալքիմիկներին, բայց այս նյութը առաջին անգամ ուսումնասիրել է շոտլանդացի քիմիկոս Թոմաս Անդերսոնը 1851 թվականին։ Նա պիրիդինը առաջին անգամ հայտնաբերել է ոսկրերի չոր թորումից, որի արդյունքում ստացվել է անդուր հոտով անգույն հեղուկ։ 1869 թվականին Կերները անձնական նամակ է ուղարկել Կենիցարին, որտեղ առաջարկել է, որ պրիիդինը կարելի է դիտել որպես բենզոլ, որում մեկ СН խումբը փոխարինվում է ազոտով։ Ըստ Կյորների, այդպիսի բանաձևը ոչ միայն բացատրում է պիրիդինի սինթեզը, այլ նաև ցույց է տալիս թե ինչու պիրիդինային հիմքի գլխավոր անդամը ունի 5 ատոմ ածխածին։
Ստացում
խմբագրելՆերկայումս պիրիդինի ստացման հիմնական աղբյուրը քարածխային խեժն է։
Քիմիական և ֆիզիկական հատկություններ
խմբագրելՊիրիդինը անգույն հեղուկ է, բնորոշ անդուր հոտով, խառնվում է ջրի հետ բոլոր հարաբերություններով։ Հալման ջերմաստիճանը՝ -42 °C, եռման՝ 115 °C, d420=0,982:
Պիրիդինի հետերոցիկլիկ վեցանդամների արտաքին տեսքը
| |||||
Պիրիդինըխառնվում է ջրի հետ բոլոր հարաբերություններով։ Նա շատ լավ լուծիչ է շատ օրգանական նյութերի հետ։ Կալիումի պերմանգանատի պիրիդինային լուծույթը հաճախ օգտագործում են օրգանական նյութերն օքսիդացնելու համար։ Իր մի քանի հատկություններով պիրիդինը հիշեցնում է բենզոլին։ Բենզոլի նման շատ կայուն է թթուների և օքսիդիչների ազդեցության տակ։
| Կրիտիկական չափեր[5] | ||
|---|---|---|
| Ճնշում | Ջերմաստիճան | Ծավալ |
| 6,70 ՄՊա | 620 K | 229 սմ3·մոլ−1 |
| Պարամետրերը ըստ Անտուանի հավասարման (340-426 °C)[6] | ||
| A | B | C |
| 4,16272 | 1371,358 | −58,496 |
| Ջերմաստիճանի կախվածությունը ճնշումից[7] (nach ΔVH0=A·exp(−β·Tr)·(1−Tr)β) zwischen 298 und 388 °C | ||
| A | β | Tc |
| 55,43 կՋ·մոլ−1 | 0,2536 | 620 K |
Պիրիդինը երրորդային ամին է և ունի նկատելի, բայց ոչ շատ ուժեղ հիմնային հատկություններ՝ նա թթուների հետ աղեր է առաջացնում, թթուների անհիդրիդների և տարբեր աղերի և հալոգենիդների հետ միացման տարբեր նյութեր է տալիս։ Միացումը իրականացվում է ազոտի մոտ եղած էլեկտրոնային զույգի միջոցով՝
Ջրածնով առաջացման ժամանակ, ինչպես և ջրածնով պլատինի ներկայությամբ, պիրիդինը վերականգնվում է մինչև հեքսահդրոպիրիդին՝ պիպերիդին.
Պիրիդինի վրա քլոր կամ բրոմ ազդելիս սկզբում առաջանում է հալոգենի ոչ կայուն միացությունը ազոտի հետ։ Հալոգենները օղակի մեջ մտնում են հատկապես β-դիրքը միայն 300-400 °C տաքացնելիս.
Նման ձևով միայն պիրիդինը խիտ ծծմբական թթվի հետ 300 °C-ից բարձր տաքացնելիս կարելի է ստանալ պիրիդին-3 սուլֆոնաթթու։ 3-նիտրոպիրիդինը ստացվում է սիլիտրայի և ծծմբական թթվի խառնուրդով 300 °C-ում նիտրացնելու միջոցով։
Ավելի հեշտ է ռեակցիայի մեջ մտնում ալկալիական մետաղների հետ։ Պիրիդինը նատրիումի ամիդի հետ տաքացնելիս հեշտ ստացվում է ά- և γ-ամինոպիրիդիններ (Ա. Ե. Չիչիբաբին).
ά-ամինոպիրիդիդինը (հալման ջերմաստիճանը 57,5 °C) կիրառվում է պիրիդինի շատ ածանցյալների ստացման համար, հատկապես նա օգտագործվում է կարևոր սուլֆամիդային դեղանյութ՝ սուլֆիդինի ստացման համար.
Կծու ալկալիները տաքացնելիս պիրիդինի վրա ազդում են նատրիումի ամիդի նման։ Այդ ժամանակ անջատվում է ջրածին և գոյանում է 2 և 4-օքսիպիրիդիններ։ Այս միացությունները կարող են ստացվել նաև համապատասխան ամինոպիրիդիների վրա ազոտական թթվով ազդելով։
Օքսիպիրիդիները նման են ֆենոլներին, նրանք գունավոր ռեակցիա են տալիս երկաթի քլորիդի հետ, լուծվում են ջրային ալկալիներում։ ά- և γ-օքսիպիրիդիները պինդ նյութեր են (ά-օքսիպիրիդինի հալման ջերմաստիճանը 107 °C է, γ-օքսիպիրիդինը՝ 148 °C), նրանք տաուտոմեր ձևով անցնում են կետոմիացությունների՝ պիրիդոնների.
Պիրիդինի կարբոնաթթուները կարող են ստացվել պիրիդինի հոմոլոգների և այլ ածանցյալների վրա օքսիդիչներ ազդելով։ 2-մեթիլպիրիդինից (ά-պիկոլին) ստացվում է պիկոլինաթթու։ Նշենք նիկոտինաթթուն (պիրիդին-3-կարբոնաթթուն), հալման ջերմաստիճանը 207 °C է, որը կարելի է ստանալ նիկոտինը ազոտական թթվով օքսիդացնելիս կամ խինոլինաթթվից տաքացնելով։ Այս թթուն վիտամին B-կազմող նյութերի խառնուրդի կարևոր բաղադրիչներից մեկն է։
Կիրառություն
խմբագրելՍուլֆիդինը օգտագործվում է վարաքիչ շատ հիվանդությունների դեմ, հատկապես թոքաբորբի և մենինգիտի ժամանակ։
Անվտանգություն
խմբագրելՊիրիդինը թունավոր է, ազդում է նյարդային համակարգի, մաշկի վրա։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 PYRIDINE
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 http://www.cdc.gov/niosh/npg/npgd0541.html
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 4,0 4,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Fluid Properties, S. 6-67.
- ↑ J. P. McCullough, D. R. Douslin, J. F. Messerly, I. A. Hossenlopp, T. C. Kincheloe, G. Waddington: Pyridine: experimental and calculated chemical thermodynamic properties between 0 and 1500 K., a revised vibrational assignment, in: J. Am. Chem. Soc., 1957, 79, S. 4289–4295; .
- ↑ V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, ISBN 0-632-01529-2.
Գրականություն
խմբագրել- Օրգանական քիմիայի դասընթաց, Բ. Ա. Պավլով, Ա. Պ. Տերենտև
- Пиридин — статья из Большой советской энциклопедии
- Д. А. Хардин Пиридин // Энциклопедический словарь Брокгауза и Ефрона։ В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Joule, J. A. and Mills, K. (2010). Heterocyclic Chemistry (5th ed.). Chichester: Blackwell Publishing. ISBN 1-4051-3300-7.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - Lide, D. R., ed. (2009). Handbook of Chemistry and Physics (90th ed.). Boca Raton: CRC Press. ISBN 978-1-4200-9084-0.
Արտաքին հղումներ
խմբագրել- Synthesis and propierties of pyridines at chemsynthesis.com
- International Chemical Safety Card 0323
- NIOSH Pocket Guide to Chemical Hazards
- Synthesis of pyridines (overview of recent methods)
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Պիրիդին» հոդվածին։ |