Հիդրոնիում
քիմիական միացություն
Հիդրոնիում, հիդրոնիումի իոն, հիդրօքսոնիումի իոն, ջրային լուծույթում ջրածնի հիդրատացված իոնը՝ ։ Լուծույթում ջրածնի ազատ իոնը (այսինքն, ջրածնի ատոմի միջուկը՝ պրոտոնը) կապվում է ջրի մոլեկուլների հետ՝ առաջացնելով, գլխավորապես հիդրոնիում՝ ։ Պրոտոնի աննշան չափի ( սմ, մնացած իոնների շառավիղները սմ կարգի են) պատճառով այն ստեղծում է էլեկտրական ուժեղ դաշտ, որի ազդեցությամբ ջրի մոլեկուլի թթվածնի ազատ էլեկտրոնային զույգի և պրոտոնի միջև առաջանում է կովալենտ կապ։ Հիդրոնիումի առաջացումը նման է ամոնիումի իոնի առաջացմանը։ Բյուրեղներում իոնը կոչվում է օքսոնիում։ Պարզված է, որ ջրի մոլեկուլների ասոցման պատճառով հիդրոնիում կապվում է մեծ քանակությամբ ջրի հետ։ Այդ դեպքում ստացված հիդրոնիումի հիդրատացված իոններն արտահայտում են բանաձևերով։
| Հիդրոնիում | |
|---|---|
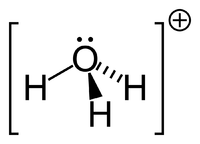 | |
| Քիմիական բանաձև | H₃O⁺ |
| Մոլային զանգված | 3,2E−26 կիլոգրամ[1] գ/մոլ |
| Քիմիական հատկություններ | |
| pKa | 0 ± 0,01[2] |
| Դասակարգում | |
| CAS համար | 13968-08-6 |
| PubChem | 123332, 44144404 |
| SMILES | [OH3+] |
| ChEBI | 109935 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Տես նաև
խմբագրելԾանոթագրություններ
խմբագրել- ↑ 1,0 1,1 Oxonium
- ↑ Binas (նիդերլ.) — 2 — Noordhoff Uitgevers, 1986. — ISBN 978-90-01-89351-4
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 6, էջ 399)։ |




