Դեղորայքային կայունություն
Դեղորայքային կայունություն ( ռեզիստենտություն ), այնպիսի դեղամիջոցների արդյունավետության նվազումն է, ինչպիսիք են հակամանրէային կամ հականեոպլաստիկ դեղամիջոցները հիվանդության կամ վիճակի բուժման մեջ[1]։ Տերմինը օգտագործվում է դիմադրության համատեքստում, որը «ձեռք են բերել» հարուցիչները կամ ուռուցքը, այսինքն՝ առաջացել է դիմադրողականություն։ Հակամանրէային դիմադրությունը և հականեոպլաստիկ դիմադրությունը մարտահրավեր են նետում կլինիկական օգնությանը և խթանում են հետազոտությունները։ Երբ մի օրգանիզմը կայուն է մեկից ավելի դեղերի նկատմամբ, ասում են բազմադեղորայքակայուն։
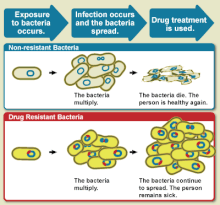
Հակաբիոտիկների նկատմամբ կայունության զարգացումը հատկապես բխում է այն դեղամիջոցներից, որոնք ուղղված են միայն կոնկրետ բակտերիաների մոլեկուլներին (գրեթե միշտ սպիտակուցներին)։ Քանի որ դեղամիջոցը շատ սպեցիֆիկ է, այս մոլեկուլների ցանկացած մուտացիա կխանգարի կամ կչեղարկի դրա կործանարար ազդեցությունը, ինչը հանգեցնում է հակաբիոտիկների դիմադրության։ Ավելին, աճում է անհանգստությունը անասնաբուժության մեջ հակաբիոտիկների չարաշահման առնչությամբ, որը միայն Եվրամիությունում կազմում է մարդկանց տրվող ծավալի եռապատիկը, ինչը հանգեցնում է գերդիմացկուն բակտերիաների զարգացմանը[2][3]։
Բակտերիաները կարող են ոչ միայն փոխել հակաբիոտիկների թիրախային ֆերմենտը, այլ նաև ֆերմենտների միջոցով փոփոխելու հակաբիոտիկն ու դրանով իսկ չեզոքացնել այն։ Թիրախը փոփոխող պաթոգենների օրինակներ են Staphylococcus aureus-ը, վանկոմիցին դիմացկուն էնտերոկոկերը և մակրոլիդակայուն Streptococcus-ը, մինչդեռ հակաբիոտիկները փոփոխող միկրոբների օրինակներ են Pseudomonas aeruginosa-ն և aminoglycoside-ակայուն Acinetobacter baumannii-ն[4]։
Կարճ ասած, կառավարությունների և դեղագործական արդյունաբերության կողմից համաձայնեցված ջանքերի բացակայությունը, ինչպես նաև միկրոբների բնածին կարողությունը՝ զարգացնելու դիմադրողականությոն նոր դեղամիջոցների մշակմանը գերազանցող արագությամբ, հուշում է, որ գոյություն ունեցող ռազմավարությունները մշակելու համար կենսունակ, երկարաժամկետ հակամանրէային թերապիաներ, վերջիվերջո, դատապարտված են ձախողման։ Առանց այլընտրանքային ռազմավարությունների, պաթոգեն միկրոօրգանիզմների կողմից դեղերի դիմադրության ձեռքբերումը կարող է լինել 21-րդ դարում մարդկության առջև ծառացած հանրային առողջության ամենակարևոր սպառնալիքներից մեկը[5]։ Հակաբիոտիկների կայունությունը նվազեցնող ամենալավ այլընտրանքային աղբյուրներից են պրոբիոտիկները, պրեբիոտիկները,դիետիկ մանրաթելերը, ֆերմենտները, օրգանական թթուները, ֆիտեգենիկները[6][7]։
Ձևեր
խմբագրելԴեղը, տոքսինը կամ քիմիական դիմադրությունը էվոլյուցիայի հետևանք է և պատասխան է ցանկացած կենդանի օրգանիզմի վրա գործադրվող ճնշումներին։ Առանձին օրգանիզմները տարբերվում են իրենց զգայունությամբ օգտագործվող դեղամիջոցի նկատմամբ, և ավելի լավ մարզավիճակ ունեցող որոշ օրգանիզմներ կարող են խուսափել դեղորայքային բուժումից։ Դեղորայքակայուն հատկությունները, համապատասխանաբար, ժառանգվում են հետագա սերունդների կողմից, ինչը հանգեցնում է դեղերի նկատմամբ ավելի կայուն պոպուլյացիայի ձևավորմանը։ Եթե օգտագործվող դեղամիջոցը անհնարին դարձնի սեռական վերարտադրությունը կամ բջիջների բաժանումը կամ հորիզոնական գենի փոխանցումը ողջ թիրախային պոպուլյացիայում, անխուսափելիորեն կհետևի դեղամիջոցի նկատմամբ դիմադրողականությունը։ Սա կարող է տեղի ունենալ քաղցկեղի ուռուցքային բջիջներում, որտեղ որոշ բջիջներ կարող են դիմադրողականություն զարգացնել քիմիաթերապիայի մեջ օգտագործվող դեղամիջոցների նկատմամբ[8]։ Քիմիաթերապիան առաջացնում է ուռուցքների մոտ գտնվող ֆիբրոբլաստներ, որոնք արտադրում են մեծ քանակությամբ WNT16B սպիտակուց։ Այս սպիտակուցը խթանում է քաղցկեղի բջիջների աճը, որոնք դեղակայուն են[9]։ Պարզվել է նաև, որ միկրո ՌՆԹ-ները ազդում են քաղցկեղի բջիջներում դեղերի ձեռքբերովի դիմադրողականության վրա և դա կարող է օգտագործվել թերապևտիկ նպատակներով[10]։ 2012 թվականին մալարիան վերածնված սպառնալիքի է վերածվել Հարավարևելյան Ասիայում և Ենթասահարյան Աֆրիկայում և Plasmodium falciparum-ի դեղակայուն շտամները հսկայական խնդիրներ են ստեղծում առողջապահական մարմինների համար[11][12]։ Բորոտությունը աճող դիմադրություն է ցույց տվել դափսոնի նկատմամբ։
Միաբջիջ օրգանիզմների միջև գոյություն ունի դիմադրության փոխանակման արագ գործընթաց, որը կոչվում է հորիզոնական գեների փոխանցում, որտեղ տեղի է ունենում գեների ուղղակի փոխանակում, հատկապես բիոֆիլմի ( բակտերիաների և այլ միկրոօրգանիզմների կառուցվածքային բարդ համալիր ) վիճակում[13]։ Նմանատիպ ասեքսուալ մեթոդ կիրառվում է սնկերի կողմից և կոչվում է «պարասեքսուալություն»։ Դեղորայքակայուն շտամների օրինակներ կարելի է գտնել միկրոօրգանիզմների, ինչպիսիք են բակտերիաները և վիրուսները, էնդո- և էկտո- մակաբույծները, բույսերը, սնկերը, հոդվածոտանիները[14][15], կաթնասունները[16], թռչունները[17], սողունները[18], ձկները և երկկենցաղները[18]։
Կենցաղային միջավայրում օրգանիզմի դեղորայքակայուն շտամներ կարող են առաջանալ թվացյալ անվտանգ գործողություններից, ինչպիսիք են սպիտակեցնող միջոցների օգտագործումը, ատամները խոզանակով լվանալը, հակաբիոտիկների, ախտահանող միջոցների և լվացող միջոցների, շամպունների և օճառների, մասնավորապես հակաբակտերիալ օճառների օգտագործումը, ձեռքերի լվացում, մակերեսային սփրեյներ, դեզոդորանտների, արևապաշտպան միջոցների և ցանկացած կոսմետիկ կամ առողջապահական միջոցի, միջատասպանների կիրառում[19]։ Այս պատրաստուկներում պարունակվող քիմիական նյութերը, բացի օգտակար օրգանիզմներին վնասելուց, կարող են դիտավորյալ կամ ակամա թիրախավորել այն օրգանիզմներին, որոնք ունեն դիմադրողականություն զարգացնելու ներուժ[20]։
Մեխանիզմներ
խմբագրելThe four main mechanisms by which microorganisms exhibit resistance to antimicrobials are[21][22]:
Չորս հիմնական մեխանիզմները, որոնց միջոցով միկրոօրգանիզմները հակամանրէային նյութերի նկատմամբ դիմադրություն են ցուցաբերում, հետևյալն են[21][22]․
- Դեղի ապաակտիվացում կամ մոդիֆիկացիա․ օր․՝ Պենիցիլինի G-ի ֆերմենտային ապաակտիվացումը որոշ պենիցիլինակայուն բակտերիաներում՝ β-լակտամազների արտադրության միջոցով։
- Թիրախ մասի փոփոխություն․ օր․՝ PBP-ի՝ պենիցիլինների կապող թիրախային տեղամասի փոփոխությունը MRSA-ում և պենիցիլին դիմացկուն այլ բակտերիաներում։
- Մետաբոլիկ ուղու փոփոխություն․ օր՝․ որոշ սուլֆոնամիդ կայուն բակտերիաներ չեն պահանջում պարաամինոբենզոյան թթու (PABA), որը կարևոր նախադրյալ է սուլֆոնամիդներով արգելակված բակտերիաներում ֆոլաթթվի և նուկլեինաթթուների սինթեզի համար։ Փոխարենը, ինչպես կաթնասունների բջիջները, նրանք դիմում են նախապես ձևավորված ֆոլաթթվի օգտագործմանը։
- Դեղի կուտակման նվազեցում․ դեղի թափանցելիության նվազեցում և/կամ մեծացնելով դեղի արտահոսքը բջջի մակերեսով էֆլյուքս պոմպերի միջոցով։
Ձեռք բերված դեղորայքակայունության մեխանիզմեր
խմբագրել| Մեխանիզմ | Հակամիկրոբային ագենտ | Դեղի գործողությունը | Կայունության մեխանիզմը |
|---|---|---|---|
| Դեղի ոչնչացում | Ամինոգլիկոզիդ
Բետա-լակտամային հակաբիոտիկներ (պենիցիլին և ցեֆալոսպորին) |
Կապում է ռիբոսոմային 30S ենթամիավորը՝ ընկճելով սպիտակուցի սինթեզը
Կապում է պենիցիլին-կապող սպիտակուցներին՝ ընկճելով պեպտիդոգլիկանի սինթեզը Կապում է ռիբոսոմային 50S ենթամիավորը՝ ընկճելով պեպտիդային կապերի ձևավորումը |
Պլազմիդը կոդավորում է այն ֆերմենտները, որոնք քիմիապես փոխում են դեղամիջոցը (օրինակ՝ ացետիլացման կամ ֆոսֆորիլացման միջոցով)՝ դրանով իսկ ինակտիվացնելով այն։
Պլազմիդը կոդավորում է բետա-լակտամազը, որը ճեղքում է բետա-լակտամ օղակը՝ ինակտիվացնելով այն։ Պլազմիդը կոդավորում է այն ֆերմենտը, որը ացետիլացնում է դեղը, այդպիսով ինակտիվացնելով այն։ |
| Դեղի թիրախի փոփոխություններ | Ամինոգլիկոզիդներ
Բետա լակտամային անտիբիոտիկներ( պենիցիլին և ցեֆալոսպորին ) Էրիթրոմիցին Քինոլոններ Ռիֆամպին Տրիմետոպրիմ |
Կապում է ռիբոսոմային 30S ենթամիավորը՝ ընկճելով սպիտակուցի սինթեզը
Կապում է պենիցիլին-կապող սպիտակուցներին՝ ընկճելով պեպտիդոգլիկանի սինթեզը Կապում է ռիբոսոմային 50S ենթամիավորը՝ ընկճելով սպիտակուցի սինթեզը Կապում է ԴՆԹ-ի տոպոիզոմերազը, ֆերմենտ, որը առանցքային է ԴՆԹ-ի սինթեզի համար Կապում է ՌՆԹ-պոլիմերազը․ ընկճում ՌՆԹ-ի սինթեզի մեկնարկը Արգելափակում է դիհիդրոֆոլատի ֆերմենտը, որը արգելակում է ֆոլաթթվի ուղին |
Բակտերիան արտադրում է փոփոխված 30S ռիբոսոմներ, որի չի կապվում դեղի հետ։
Բակտերիան արտադրում է փոփոխված պենիցիլին կապող պրոտեիններ, որը չի կապվում դեղի հետ։ Բակտերիան արտադրում է 50S ռիբոսոմի փոփոխված ձև, որը չի կապվում դեղի հետ։ Բակտերիան արտադրում է ԴՆԹ տոպոիզոմերազի փոփոխված ձև, որը չի կապվում դեղի հետ։ Բակտերիան արտադրում է պոլիմերազի փոփոխված ձև, որը չի կապվում դեղի հետ։ Բակտերիան արտադրում է ֆերմենտի փոփոխված ձև, որը չի կապվում դեղի հետ։ |
| Դեղի ներթափանցման ընկճում կամ դեղի դուրս բերում | Պենիցիլին
Էրիթրոմիցին Տետրացիկլին |
Կապում է պենիցիլին-կապող սպիտակուցներին՝ ընկճելով պեպտիդոգլիկանի սինթեզը
Կապում է ռիբոսոմային 50S ենթամիավորը՝ ընկճելով սպիտակուցի սինթեզը Կապում է ռիբոսոմային 30S ենթամիավորը, ընկճում սպիտակուցի սինթեզը՝ արգելակելով փ-ՌՆԹ-ն |
Բակտերիաները փոխում են արտաքին թաղանթի պորինային սպիտակուցների ձևը, ինչը թույլ չի տալիս դեղամիջոցի ներթափանցումը բջիջ։
Նոր թաղանթային փոխադրման համակարգը թույլ չի տալիս դեղի ներթափանցումը բջիջ։ Նոր թաղանթային փոխադրման համակարգը դեղը դուրս է մղում բջջից։ |
Մետաբոլիկ արժեք
խմբագրելԿենսաբանական արժեքը հանդիսանում է ֆունկցիայի հասնելու համար պահանջվող ավելացված էներգիայի նյութափոխանակության չափանիշ։
Դեղորայքային կայունությունը ունի բարձր մետաբոլիկ արժեք[25] այն պաթոգեններում, որոնց համար այս հայեցակարգը տեղին է( բակտերիա[26], ներքին մակաբույծներ և ուռոցքային բջիջներ )։ Վիրուսներում, համարժեք «արժեքը» գենոմային բարդությունն է։ Բարձր մետաբոլիկ արժեքը նշանակում է, որ հակաբիոտիկների բացակայության դեպքում դիմացկուն պաթոգենը կունենա էվոլյուցիոն պիտանիության նվազում՝ համեմատած զգայուն պաթոգենների հետ[27]։ Սա պատճառներից մեկն է, որ դեղերի կայունության հարմարվողականությունը հազվադեպ է նկատվում այն միջավայրում, որտեղ հակաբիոտիկները բացակայում են:Այնուամենայնիվ, հակաբիոտիկների առկայության դեպքում գոյատևման առավելությունը փոխհատուցում է նյութափոխանակության բարձր արժեքը և թույլ է տալիս կայուն շտամներին բազմանալ։
Բուժում
խմբագրելՄարդկանց մոտ ABCB1 գենը կոդավորում է MDR1 (p-glycoprotein), որը հանդիսանում է բջջային մակարդակում դեղերի հիմնական փոխադրողը։ Եթե MDR1-ը գերարտադրվում է ապա դեղի կայունությունը բարձրանում է[28]։ Հետևաբար, ABCB1 մակարդակները կարող են վերահսկվել[28]։ ABCB1 էքսպրեսիայի բարձր մակարդակ ունեցող հիվանդների մոտ երկրորդական բուժման օգտագործումը, ինչպիսին է մետֆորմինը, որոշ հաջողությամբ օգտագործվել է առաջնային դեղորայքային բուժման հետ համատեղ[28]։
Հակաբիոտիկների դիմադրության համար, որը մեր օրերում տարածված խնդիր է, ստեղծվում են դեղամիջոցներ, որոնք նախատեսված են բակտերիալ հակաբիոտիկների դիմադրության մեխանիզմները արգելակելու համար։ Օրինակ, բետա լակտամային հակաբիոտիկների (օրինակ՝ պենիցիլինի և ցեֆալոսպորինների) նկատմամբ բակտերիաների դիմադրությունը կարող է շրջանցվել՝ օգտագործելով այնպիսի հակաբիոտիկներ, ինչպիսին է Նաֆցիլինը, որոնք ենթակա չեն ոչնչացման որոշ բետա-լակտամազների կողմից (բետա-լակտամների քայքայման համար պատասխանատու ֆերմենտների խումբ)[29]։ Բետա-լակտամային բակտերիաների դիմադրողականության խնդիրը կարող է լուծվել նաև բետա-լակտամային հակաբիոտիկներ ընդունելով այնպիսի դեղամիջոցներով, որոնք արգելափակում են բետա-լակտամազները, ինչպիսին է կլավուլանաթթուն, որպեսզի հակաբիոտիկները կարողանան գործել առանց բակտերիաների կողմից նախապես ոչնչացվելու[30]։ Վերջերս հետազոտողները բացատրում են նոր դեղամիջոցների անհրաժեշտությունը, որոնք կընկճեն բակտերիաների էֆլյուքս պոմպերը, որոնք առաջացնում են բազմադեղորայքակայունություն այնպիսի դեղերի հանդեպ, ինչպիսիք են բետա-լակտամները, քինոլոնները, քլորամֆենիկոլը և տրիմետոպրիմը՝ այդ հակաբիոտիկների մոլեկուլները բակտերիալ բջիջից դուրս մղելով[31][32]։ Երբեմն տարբեր դասերի հակաբիոտիկների համակցությունը կարող է օգտագործվել սիներգետիկորեն. այսինքն՝ նրանք միասին աշխատում են ավելի արդյունավետ այն բակտերիաների դեմ, որոնք կարող են կայուն լինել միայն հակաբիոտիկներից մեկի նկատմամբ[33]։
Դիմակայուն բակտերիաների ոչնչացումը կարող է իրականացվել նաև ֆագային թերապիայի միջոցով, որի ժամանակ օգտագործվում է հատուկ բակտերիոֆագ (վիրուս, որը սպանում է բակտերիաները)[34]։
Ծանոթագրություններ
խմբագրել- ↑ Alfarouk, KO; Stock, CM; Taylor, S; Walsh, M; Muddathir, AK; Verduzco, D; Bashir, AH; Mohammed, OY; Elhassan, GO; Harguindey, S; Reshkin, SJ; Ibrahim, ME; Rauch, C (2015). «Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp». Cancer Cell International. 15: 71. doi:10.1186/s12935-015-0221-1. PMC 4502609. PMID 26180516.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Harvey, Fiona (2016 թ․ հոկտեմբերի 16). «Use of strongest antibiotics rises to record levels on European farms». the Guardian. Վերցված է 2018 թ․ հոկտեմբերի 1-ին. Կաղապար:Verify source
- ↑ Duckenfield, Joan (2011 թ․ դեկտեմբերի 30). «Antibiotic Resistance Due to Modern Agricultural Practices: An Ethical Perspective». Journal of Agricultural and Environmental Ethics (անգլերեն). 26 (2): 333–350. doi:10.1007/s10806-011-9370-y. ISSN 1187-7863. S2CID 55736918. Կաղապար:Verify source
- ↑ Fisher, Jed F.; Mobashery, Shahriar (2010). «Enzymology of Bacterial Resistance». Comprehensive Natural Products II. Volume 8: Enzymes and Enzyme Mechanisms. Elsevier. էջեր 443–201. doi:10.1016/B978-008045382-8.00161-1. ISBN 978-0-08-045382-8. Կաղապար:Verify source
- ↑ Institute of Medicine (US) Forum on Emerging Infections; Knobler, S. L.; Lemon, S. M.; Najafi, M.; Burroughs, T. (2003). Reading: The Resistance Phenomenon in Microbes and Infectious Disease Vectors: Implications for Human Health and Strategies for Containment -- Workshop Summary - The National Academies Press. doi:10.17226/10651. ISBN 978-0-309-08854-1. PMID 22649806.
{{cite book}}:|work=ignored (օգնություն) Կաղապար:Verify source - ↑ Jha, Rajesh; Das, Razib; Oak, Sophia; Mishra, Pravin (2020). «Probiotics (Direct-Fed Microbials) in Poultry Nutrition and Their Effects on Nutrient Utilization, Growth and Laying Performance, and Gut Health: A Systematic Review». Animals (անգլերեն). 10 (10): 1863. doi:10.3390/ani10101863. PMC 7602066. PMID 33066185.
- ↑ Jha, Rajesh; Mishra, Pravin (2021 թ․ ապրիլի 19). «Dietary fiber in poultry nutrition and their effects on nutrient utilization, performance, gut health, and on the environment: a review». Journal of Animal Science and Biotechnology. 12 (1): 51. doi:10.1186/s40104-021-00576-0. ISSN 2049-1891. PMC 8054369. PMID 33866972.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ «Tolerance and Resistance to Drugs». Merck Manuals Consumer Version.
- ↑ "Chemo 'Undermines Itself' Through Rogue Response",BBC News, 5 August 2012.
- ↑ Ghasabi M, Mansoori B, Mohammadi A, Duijf PH, Shomali N, Shirafkan N, Mokhtarzadeh A, Baradaran B (2019). «MicroRNAs in cancer drug resistance: Basic evidence and clinical applications». Journal of Cellular Physiology. x (3): 2152–2168. doi:10.1002/jcp.26810. PMID 30146724. S2CID 52092652.
- ↑ McGrath, Matt (2012 թ․ ապրիլի 5). «Resistance spread 'compromising' fight against malaria». BBC News.
- ↑ Morelle R (2015 թ․ հոկտեմբերի 20). «Drug-resistant malaria can infect African mosquitoes». BBC News. Վերցված է 2015 թ․ հոկտեմբերի 21-ին.
- ↑ Molin S, Tolker-Nielsen T (2003 թ․ հունիս). «Gene transfer occurs with enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure». Current Opinion in Biotechnology. 14 (3): 255–61. doi:10.1016/S0958-1669(03)00036-3. PMID 12849777.
- ↑ Brun LO, Wilson JT, Daynes P (1983 թ․ մարտ). «Ethion resistance in the cattle tick (Boophilus microplus) in New Caledonia» (PDF). International Journal of Pest Management. 29 (1): 16–22. doi:10.1080/09670878309370763.
- ↑ «Review Article on Colorado Potato Beetle Resistance to Insecticides». potatobeetle.org. Վերցված է 2018 թ․ հոկտեմբերի 1-ին.
- ↑ Lund M (1972). «Rodent resistance to the anticoagulant rodenticides, with particular reference to Denmark». Bulletin of the World Health Organization. 47 (5): 611–8. PMC 2480843. PMID 4540680.
- ↑ Shefte N, Bruggers RL, Schafer EW (1982 թ․ ապրիլ). «Repellency and toxicity of three bird control chemicals to four species of African grain-eating birds». The Journal of Wildlife Management. 46 (2): 453–7. doi:10.2307/3808656. JSTOR 3808656.
- ↑ 18,0 18,1 «Reptiles Magazine, your source for reptile and herp care, breeding, and enthusiast articles». reptilechannel.com. Արխիվացված է օրիգինալից 2011 թ․ հունվարի 3-ին.
- ↑ Yoon KS, Kwon DH, Strycharz JP, Hollingsworth CS, Lee SH, Clark JM (2008 թ․ նոյեմբեր). «Biochemical and molecular analysis of deltamethrin resistance in the common bed bug (Hemiptera: Cimicidae)». Journal of Medical Entomology. 45 (6): 1092–101. doi:10.1603/0022-2585(2008)45[1092:BAMAOD]2.0.CO;2. PMID 19058634. S2CID 27422270.
- ↑ «Antibacterial cleaning products». Australian Department of Health & Human Services. Արխիվացված է օրիգինալից 2015 թ․ մարտի 4-ին. Վերցված է 2018 թ․ հոկտեմբերի 1-ին.
- ↑ 21,0 21,1 Li XZ, Nikaido H (2009 թ․ օգոստոս). «Efflux-mediated drug resistance in bacteria: an update». Drugs. 69 (12): 1555–623. doi:10.2165/11317030-000000000-00000. PMC 2847397. PMID 19678712.
- ↑ 22,0 22,1 Sandhu P, Akhter Y (2018 թ․ հունվար). «Evolution of structural fitness and multifunctional aspects of mycobacterial RND family transporters». Archives of Microbiology. 200 (1): 19–31. doi:10.1007/s00203-017-1434-6. PMID 28951954. S2CID 13656026.
- ↑ Catherine A. Ingraham, John L. Ingraham (2000). Introduction to Microbiology second edition.
- ↑ Catherine A. Ingraham, John L. Ingraham (2000). Introduction to Microbiology.
- ↑ Gillespie SH, McHugh TD (1997 թ․ սեպտեմբեր). «The biological cost of antimicrobial resistance». Trends in Microbiology. 5 (9): 337–9. doi:10.1016/S0966-842X(97)01101-3. PMID 9294886.
- ↑ Wichelhaus TA, Böddinghaus B, Besier S, Schäfer V, Brade V, Ludwig A (2002 թ․ նոյեմբեր). «Biological cost of rifampin resistance from the perspective of Staphylococcus aureus». Antimicrobial Agents and Chemotherapy. 46 (11): 3381–5. doi:10.1128/AAC.46.11.3381-3385.2002. PMC 128759. PMID 12384339.
- ↑ Händel, Nadine; Schuurmans, J. Merijn; Brul, Stanley; ter Kuile, Benno H. (2013 թ․ օգոստոս). «Compensation of the Metabolic Costs of Antibiotic Resistance by Physiological Adaptation in Escherichia coli». Antimicrobial Agents and Chemotherapy. 57 (8): 3752–3762. doi:10.1128/AAC.02096-12. ISSN 0066-4804. PMC 3719774. PMID 23716056.
- ↑ 28,0 28,1 28,2 Ramos-Peñafiel C, Olarte-Carrillo I, Cerón-Maldonado R, Rozen-Fuller E, Kassack-Ipiña JJ, Meléndez-Mier G, Collazo-Jaloma J, Martínez-Tovar A (2018 թ․ սեպտեմբեր). «Effect of metformin on the survival of patients with ALL who express high levels of the ABCB1 drug resistance gene». Journal of Translational Medicine (անգլերեն). 16 (1): 245. doi:10.1186/s12967-018-1620-6. PMC 6122769. PMID 30176891.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Barber M, Waterworth PM (1964 թ․ օգոստոս). «Penicillinase-resistant Penicillins and Cephalosporins». British Medical Journal. 2 (5405): 344–9. doi:10.1136/bmj.2.5405.344. PMC 1816326. PMID 14160224.
- ↑ Bush K (1988 թ․ հունվար). «Beta-lactamase inhibitors from laboratory to clinic». Clinical Microbiology Reviews. 1 (1): 109–23. doi:10.1128/CMR.1.1.109. PMC 358033. PMID 3060240.
- ↑ Webber MA, Piddock LJ (2003 թ․ հունվար). «The importance of efflux pumps in bacterial antibiotic resistance». The Journal of Antimicrobial Chemotherapy. 51 (1): 9–11. doi:10.1093/jac/dkg050. PMID 12493781.
- ↑ Tegos GP, Haynes M, Strouse JJ, Khan MM, Bologa CG, Oprea TI, Sklar LA (2011). «Microbial efflux pump inhibition: tactics and strategies». Current Pharmaceutical Design. 17 (13): 1291–302. doi:10.2174/138161211795703726. PMC 3717411. PMID 21470111.
- ↑ Glew RH, Millering RS, Wennersten C (1975 թ․ հունիս). «Comparative synergistic activity of nafcillin, oxacillin, and methicillin in combination with gentamicin against». Antimicrobial Agents and Chemotherapy. 7 (6): 828–32. doi:10.1128/aac.7.6.828. PMC 429234. PMID 1155924.
- ↑ Lin, Derek M; Koskella, Britt; Lin, Henry C (2017). «Phage therapy: An alternative to antibiotics in the age of multi-drug resistance». World Journal of Gastrointestinal Pharmacology and Therapeutics (անգլերեն). 8 (3): 162–173. doi:10.4292/wjgpt.v8.i3.162. ISSN 2150-5349. PMC 5547374. PMID 28828194.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link)
Արտաքին հղումներ
խմբագրել- BURDEN of Resistance and Disease in European Nations—An EU project to estimate the financial burden of antibiotic resistance in European hospitals
- Merck - Tolerance and Resistance
- Cosmetics Database
- HCMV drug resistance mutations tool
- Combating Drug Resistance - An informative article on multidrug resistance
- Battle of the Bugs: Fighting Antibiotic Resistance
- MDRIpred : A web server for predicting inhibitors against drug tolerant M. Tuberculosis, published in Chemistry Central Journal
- CancerDR: Cancer Drug Resistance Database. Scientific Reports 3, 1445