Ամոնիում
քիմիական միացություն
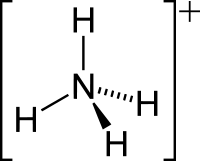
Ամոնիում NH4+, անօրգանական իոն։ Տերմինն առաջարկել է Հ. Դեին (1808)։ Ամոնիում ջրածին իոնի և ամոնիակի միացման արագությունը։
| Ամոնիում | |
|---|---|
 | |
| Քիմիական բանաձև | H₄N⁺ |
| Մոլային զանգված | 3,0E−26 կիլոգրամ[1] գ/մոլ |
| Քիմիական հատկություններ | |
| Դասակարգում | |
| CAS համար | 14798-03-9 |
| PubChem | 223, 16741146 |
| SMILES | [NH4+] |
| ChEBI | 218 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |

Միացաումը տեղի է ունենում ի հաշիվ ազոտի չօգտագործված էլեկտրոնային զույգի։ Ամոնիում ունի կանոնավոր քառանիստի կառուցվածք, որի գագաթներին գտնվում են իրար համարժեք ջրածնի ատոմներ։
Հատկություններ
խմբագրելՄիացություններում միարժեք մետաղի դեր է կատարում։ Լուծույթներում գոյություն ունի NH4+ իոնի ձևով։ Ամոնիումի հիդրօքսիդը հիմք է, առաջացնում է ջրում լուծելի աղեր՝ ամոնիումի կարբոնատ, ամոնիումի նիտրատ, ամոնիումի սուլֆատ, ամոնիումի քլորիդ և այլն։
Ծանոթագրություններ
խմբագրելԳրականություն
խմբագրել- Некрасов Б. В. Основы общей химии. — 14-е изд. — М.: Госхимиздат, 1962. — 976 с.
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 326)։ |
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ամոնիում» հոդվածին։ |