Մասնակից:Elya Minasyan/Ավազարկղ
https://en.wikipedia.org/wiki/B_cell
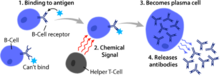

B բջիջներ, կոչվում են նաեւ՝ B լիմֆոցիտններ, լիմֆոցիտների ենթատիպին պատկանող սպիտակ արյան բջիջների տեսակ են: [1] Նրանք գործում են ձեռքբերովի հիմունիտետի հումորալ իմունիտետ բաղադրիչում: [1] B բջիջները արտադրում են հակամարմինների մոլեկուլներ, սակայն, այդ հակամարմինները չեն արտազատվում: Փոխարենը, դրանք տեղադրվում են պլազմային թաղանթի մեջ, որտեղ նրանք ծառայում են որպես B- բջիջների ընկալիչների մաս : [2] Երբ նաիվ կամ հիշողության B բջիջն ակտիվանում է անտիգենի կողմից, այն բազմանում է և տարբերվում է հակամարմիններ արտազատող էֆեկտորային բջջի, որը հայտնի է որպես պլազմատիկ բջիջ: [3] Ի հավելում դրան, B բջիջները ներկայացնում են անտիգեններ (դրանք դասակարգվում են նաև որպես պրոֆեսիոնալ հակածին ներկայացնող բջիջներ (ՀՆԲ) ) և արտազատում են ցիտոկիններ: [1] Կաթնասունների մոտ B բջիջները հասունանում են ոսկրածուծում, որը ոսկորների մեծ մասի հիմքում է: [4] Թռչունների մոտ Բ բջիջները հասունանում են հատուկ ավշային օրգանում՝ ֆաբրիցյան պարկում, որտեղ Բ բջիջները առաջին անգամ հայտնաբերվել են Չանգի և Գլիկի կողմից [4] այդ իսկ պատճառով «B» է կոչվում, ,,bursa,, բառից, այլ ոչ թե կապված է ոսկրածուծի հետ, ինչպես սովորաբար ներկայացվում է:
B բջիջները, ի տարբերություն լիմֆոցիտների մյուս երկու դասերի՝ T բջիջներըի և բնական քիլլեր բջիջների, իրենց բջջաթաղանթի վրա էքսպրեսում են B բջիջների ընկալիչներ: [5] Այդ ընկալիչները թույլ են տալիս B բջջինկապվել հատուկ անտիգենի հետ, որի դեմ այն իրականացնելու է հակամարմնային պատասխանը: [5]
Զարգացում
խմբագրելB բջիջները զարգանում են արյունաստեղծ ցողունային բջիջներից (ԱՑԲ), որոնք ծագում են ոսկրածուծից։ [6] [7] ԱՑԲ-ները սկզբում տարբերակվում են մեջ մուլտիպոտենտ պրոգենիտոր բջիջների, ապա սովորական լիմֆոիդ պրոգենիտոր բջիջների։[7] Այստեղից սկսած, նրանց զարգացումը տեղի ունենալով մի քանի փուլերով ուղղված է հենց B բջիջների ձեւավորմանը (նկարում պատկերված է աջից), որոնցից յուրաքանչյուրը նշվում է գեների էքսպրեսիայի տարբեր ձևերով և իմունոգլոբուլինի H շղթայի և L շղթայի գեների տեղակայմամբ, վերջինը պայմանավորված է B բջիջներ կախյալ V (D) J ռեկոմբինացիայով, երբ դրանք զարգանում են: [8]
Պատշաճ զարգացում ապահովելու համար, B բջիջները ոսկրածուծում զարգանալու ընթացքում ենթարկվում են երկու տեսակի ընտրության, որոնք երկուսն էլ կապված են բջջի մակերեսի B բջջային ռեցեպտորների հետ(BCR)։ Դրական ընտրությունը տեղի է ունենում անտիգենից անկախ ազդանշանման միջոցով, որը ներառում է և՛ նախա-BCR-ը, և՛ BCR-ը[9] [10]: Եթե այդ ռեցեպտորները չեն կապվում իրենց լիգանդի հետ, B բջիջները չեն ստանում համապատասխան ազդանշանը եւ զարգացումը կասեցվում է[11][12]։ Բացասական ընտրությունը տեղի է ունենում երբ BCR-ի հետ սեփական անտիգենի(self-antigen) կապումով․ եթե ամուր է կապվում, B բջիջը անցնում է չորս վիճակներից մեկը՝ կլոնալ ոչնչացում, ռեցեպտորի խմբագրում, աներգիայի եւ անտեսման(B բջիջը անտեսում է ազդանշանները եւ շարունակում է զարգացումը)[12]։ Այս բացասական ընտրության գործընթացը հանգեցնում է կենտրոնական հանդուրժողականության մի վիճակի, երբ հասուն B բջիջները չեն կապում ոսկրածուծում առկա սեփական հակածինները[13]:
Զարգացումն ավարտելու համար․ անհաս B բջիջները ոսկրածուծից գաղթում են փայծաղ որպես անցումային B բջիջներ, իրականացնում են անցում երկու անցումային փուլերով՝ T1 եւ T2[14]։ Նրանց ամբողջ միգրացիայի ընթացքում դեպի փայծաղ եւ փայծաղը մտնելուց հետո համարվում են T1 B բջիջներ[15]: Փայծաղի ներսում, T1 B բջիջները վերափոխվում են T2 B բջիջների։ T2 B բջիջները տարբերակվում են ինչպես ֆոլիկուլյար B բջիջների, այնպես էլ՝ մարգինալ գոտու B բջիջների, կախված BCR /կամ այլ ռեցեպտորներից/ ստացվող ազդանշաններից[16]։ Մեկ անգամ տարբերակվելով, նրանք արդեն համարվում են հասուն կամ նաիվ B բջիջներ[15]։
Ակտիվացում
խմբագրելB բջջի ակտիվացումը տեղի է ունենում երկրորդային լիմֆոիդ օրգաններում(ԵԼՕ), ինչպիսիք են փայծաղը և ավշային հանգույցները[17]։ Ոսկրածուծում B բջիջների հասունացումից հետո նրանք արյան միջոցով տեղափոխվում են ԵԼՕ-ներ, որոնք շրջանառվող ավշի միջոցով ստանում են անտիգենի անընդհատ պաշարներ [18]։ ԵԼՕ-ում B բջիջների ակտիվացումը սկսվում է այն ժամանակ, երբ B բջիջը իր BCR- ով միանում է անտիգենին[19]։ Չնայած ակտիվացումից անմիջապես հետո տեղի ունեցող իրադարձությունները դեռ պետք է ամբողջությամբ որոշվեն, ենթադրվում է, որ B բջիջներն ակտիվանում են կինետիկ տարանջատման մոդելին համապատասխան[փա՞ստ], ի սկզբանե որոշվել է T լիմֆոցիտներում:
Այս մոդելը նշանակում է, որ մինչ անտիգենի խթանումը, ընկալիչները ցրված են թաղանթով՝ հավասար հաճախականությամբ շփվելով Lck-ի եւ CD45- ի հետ` ստեղծելով ֆոսֆորիլացման եւ ոչ-ֆոսֆորիլացման հավասարակշռություն։
Միայն այն ժամանակ, երբ բջիջը շփվում է անտիգեն ներկայացնող բջիջի հետ, երկու բջջաթաղանթների սերտ հպան շնորհիվ, մեծ CD45 մոլեկուլը տեղափոխվում է։
Սա թույլ է տալիս իրականացնել BCR-ի ուղղակի ֆոսֆորիլացումը եւ ազդանշանի փոխանցման ուղու սկիզբն է: Երեք B բջիջների ենթաբազմություններից ֆոլիկուլյար B բջիջները նախընտրելիորեն ենթարկվում են T բջիջներից կախված ակտիվացման, մինչդեռ մարգինալլ զոնայի B բջիջները և B1 B բջիջները ենթարկվում են T բջիջներից անկախ ակտիվացման [20]։
B բջիջների ակտիվացումը բարելավվում է մակերեսային ընկալիչ CD21-ի միջոցով` CD19 և CD81 սպիտակուցների կոմպլեքսում, (բոլորն էլ հայտնի են որպես B բջիջների կոռեցեպտորային կոմպլեքս)[21]։ Երբ BCR-ը կապում է անտիգենին, որը կապված է կոմպլեմենտի C3 սպիտակուցի ֆրագմենտին, CD21-ը կապվում է C3 ֆրագմենտին, այդպիսով կապվում է արդեն կապված BCR- ի հետ եւ ազդանշանները փոխանցվում են CD19- ի եւ CD81- ի միջոցով `բջջի ակտիվացման շեմն իջեցնելու համար[22]։
T բջիջ կախյալ ակտիվացում
խմբագրելԱնտիգենները, որոնք T բջիջների միջոցով ակտիվացնում են B բջիջներին, հայտնի են որպես T բջիջ կախյալ անտիգեններ եւ ներառում են օտարածին սպիտակուցներ[23]։ Այդպիսի անվանումը գալիս է նրանից, որ այդ անտիգենները ի վիճակի չեն առաջացնել հումորալ պատասխան այն օրգանիզմներում, որոնք չունեն T բջիջներ [23]։ B բջւային պատասխանն այս անտիգենների նկատմամբ տեւում է մի քանի օր, չնայած դրան առաջացած հակամարմիններն ունեն ավելի մեծ աֆինություն եւ ֆունկցիոնալ ավելի բազմակողմանի են, քան T բջիջ-անկախ ակտիվացումից առաջացածները անտիգենները[23]։
Երբ BCR- ն կապում է T բջիջ կախյալ անտիգենին, անտիգենը ընկալիչ միջնորդված էնդոցիտոզի միջոցով անցնում է B բջիջ, դեգրադացվում եւ ներկայացվում է T բջիջների վրա պեպտիդային հատվածների ձեւով` բջջաթաղանթի MHC-II մոլեկուլների միջոցով[24]։ T օգնական (T H ) բջիջները, մասնավորապես ֆոլիկուլային T օգնական բջիջները ճանաչում և կապում են այս MHC-II — պեպտիդ կոմպլեքսներին իրենց T բջջային ընկալիչների (TCR) միջոցով[25]։ TCR-ը MHC-II- պեպտիդին կապելուց հետո T բջիջները իրենց մակերեսին էքսպրեսում են մակերեսային CD40L սպիտակուցը, ինչպես նաև արտադրում են ցիտոկիններ, ինչպիսիք են IL-4 և IL-21 [25]։ CD40L- ը ծառայում է որպես անհրաժեշտ կոստիմուլացնող գործոն B բջիջների ակտիվացման համար` կապվելով B բջիջների մակերեսային ընկալիչ CD40-ին, ինչը նպաստում է B բջիջների պրոլիֆերացիային, իմունոգլոբուլինի դասի անջատմանը և սոմատիկ հիպերմուտացիային, ինչպես նաև ապահովում է T բջիջների աճն ու տարբերակումը[26]։ T բջիջներից ստացված ցիտոկինները, կապվում են B բջիջների ցիտոկինային ընկալիչներին, եւ նույն ձեւով նպաստում են B բջիջների պրոլիֆերացիային, իմունոգլոբուլինի դասի անջատմանը եւ սոմատիկ հիպերմուտացիային, ինչպես նաև տարբերակմանը[25]։ Այս ազդանշաններն ստանալուց հետո B բջիջներն համարվում են ակտիվացված[25]։
Ակտիվանալուց հետո B բջիջները մասնակցում են երկաստիճան տարբերակման գործընթացին, որը տալիս է եւ՛ կարճաժամկետ պլազմաբլաստներ՝ անհապաղ տիպի պաշտպանության համար, եւ՛ երկարատեւ պլազմային բջիջներ եւ հիշողություն B բջիջներ՝ կայուն պաշտպանության համար[27]: Առաջին քայլը, որը հայտնի է որպես արտաֆոլիկուլային պատասխան, տեղի է ունենում լիմֆոիդ ֆոլիկուլներից դուրս, բայց դեռ ԵԼՕ-ում է[27]: Այս փուլում ակտիվացված B բջիջները բազմանում են, կարող են ենթարկվել իմունոգլոբուլինի դասի անցման և տարբերակվել պլազմաբլաստների, որոնք առաջացնում են վաղ, թույլ հակամարմիններ, հիմնականում IgM դասի[28]: Երկրորդ քայլը կատարվում է, երբ ակտիվացված B բջիջները մտնում են լիմֆոիդ ֆոլիկուլ եւ ստեղծում են գերմինալ կենտրոն, որը հանդիսանում է մասնագիտացված միկրոմիջավայր՝ B բջիջների ինտենսիվ պրոլիֆերացիայի, իմունոգլոբուլինի դասի փոխարկման եւ աֆֆինությամբ հասունացման համար, որն ուղղորդված է սոմատիկ հիպերմուտացիայի կողմից[29]։
Այս գործընթացներին նպաստում են գերմինալ գոտու ֆոլիկուլյար T օգնական բջիջները և առաջացնում ինչպես բարձր աֆֆինությամբ հիշողության B բջիջներ, այնպես էլ երկարատեւ ապրող պլազմային բջիջներ[27]: Արդյունքում առաջացած պլազմային բջիջները արտազատում են մեծ քանակությամբ հակամարմիններ, որոնց մի մասը մնում են երկրորդյաին լիմֆոիդ օրգանում, իսկ մյուս մասը, որն ավելի նպատակահարմար է, տեղափոխվում է ոսկրածուծ[25]:
T բջիջ անկախ ակտիվացում
խմբագրելԱռանց T բջջի միջնորդության B բջիջներին ակտիվացնող անտիգենները կոչվում են T բջիջ անկախ անտիգեններ[30], դրանք օտարածին պոլիսախարիդներն չմեթիլացված CpG ԴՆԹ-ն է[27]։ Անվանումը պայմանավորված է նրանով, որ T բջիջներից զուրկ օրգանիզմներում կարող են խթանել հումորալ իմու պատասխան[30]։
Այս անտիգենների նկատմամբ B բջիջների արձագանքը արագ է, թեեւ առաջացած հակամարմինները ունեն ավելի ցածր աֆֆինություն եւ ֆունկցիոնալ առումով պակաս բազմակողմանի են, համեմատած T բջիջ կախյալ ատիվացումից առաջացած հակամարմինների հետ[30]:
B բջիջների ակտիվացումը T բջիջ անկախ անտիգենների կողմից կատարվում է լլրացուցիչ ազդանշանների ստացմամբ, որպեսզի ամբողջական ակտիվանա։ Դրա համար մանրէների բաղկացուցիչները պետք է ճանաչվեն եւ կապվեն Toll -նման ընկալիչներին, մյուս կողմից հարկավոր է բակտերիալ բջջի կրկնվող էպիտոպների լայնածավալ crosslinking-ի իրականացում B բջիջների ընկալիչների կողմից(BCR)[30]: B բջիջները պրոլիֆերացվում են լիմֆոիդ ֆոլիկուլից դուրս, բայց դեռ լիմֆատիկ օրգանում, հնարավոր է իմունոգլոբուլինի դասի անցում եւ տարբերակում կարճատեւ ապրող պլազմոբլաստների, որոնք արտադրում են IgM, բայց նաեւ որոշ պոպուլացիաներ տարբերակվում են երկարատեւ ապրող պլազմային բջիջների[31]։
Հիշողության B բջիջներ
խմբագրելՀիշողության B բջջի ակտիվացումը, որը տարածվել է ծնողական B բջջից, սկսվում է թիրախ անտիգենրի հայտնաբերումով եւ կապումով[32]։ Որոշ հիշողության B բջիջներ կարողանում են ակտիվանալ առանց T բջջի օգնության, ինչպես օրինակ որոշ վիրուս սպեցիֆիկ հիշողության B բջիջներ, բայց մնացածը կարիք ունեն T բջջի օգնության[33]։ Անտիգենի կապումից հետո, հիշողության B բջիջը վերցնում է անտիգենը ընկալիչ միջնորդավորված էնդոցիտոզի միջոցով, քայքայում է այն եւ բջջաթաղանթի վրա որպես պեպտիդային մասեր՝ MHC-II մոլեկուլների կազմում, ներկայացնում է T բջիջներին[32]։ Հիշողության T օգնական բջիջները, սովորաբար հիշողության ֆոլիկուլային T օգնական բջիջները, որոնք ստացվել են նույն անտիգենով ակտիվացված T բջիջներից, ճանաչում եւ կապում են MHC-II-պեպտիդային կոմպլեքսները իրենց T բջջային ռեցեպտորների միջոցով[32]: Դրանից հետո հիշողության B բջիջը ակտիվանում է եւ տարբերակվում պլազմոբլաստներ եւ պլազմային բջիջների՝ արտաֆոլիկուլային պատասխանով կամ գերմինալ կենտրոնի ռեակցիայի մեջ մտնելու միջոցով, որտեղ նրանք առաջացնում են պլազմային բջիջներ եւ ավելի շատ հիշողության B բջիջներ[32][33]։ Դեռեւս անհասկանալի է, արդյոք հիշողության B բջիջները անցնում են հետագա աֆֆինության հասունացում երկրոդային գերմինալ կենտրոններում, թե՝ ոչ[32]։
B cell types
խմբագրել- Plasmablast – A short-lived, proliferating antibody-secreting cell arising from B cell differentiation.[30] Plasmablasts are generated early in an infection and their antibodies tend to have a weaker affinity towards their target antigen compared to plasma cell.[27] Plasmablasts can result from T cell-independent activation of B cells or the extrafollicular response from T cell-dependent activation of B cells.[30]
- Plasma cell – A long-lived, non-proliferating antibody-secreting cell arising from B cell differentiation.[30] There is evidence that B cells first differentiate into a plasmablast-like cell, then differentiate into a plasma cell.[27] Plasma cells are generated later in an infection and, compared to plasmablasts, have antibodies with a higher affinity towards their target antigen due to affinity maturation in the germinal center (GC) and produce more antibodies.[27] Plasma cells typically result from the germinal center reaction from T cell-dependent activation of B cells, however they can also result from T cell-independent activation of B cells.[31]
- Lymphoplasmacytoid cell – A cell with a mixture of B lymphocyte and plasma cell morphological features that is thought to be closely related to or a subtype of plasma cells. This cell type is found in pre-malignant and malignant plasma cell dyscrasias that are associated with the secretion of IgM monoclonal proteins; these dyscrasias include IgM monoclonal gammopathy of undetermined significance and Waldenström's macroglobulinemia.[34]
- Memory B cell – Dormant B cell arising from B cell differentiation.[30] Their function is to circulate through the body and initiate a stronger, more rapid antibody response (known as the anamnestic secondary antibody response) if they detect the antigen that had activated their parent B cell (memory B cells and their parent B cells share the same BCR, thus they detect the same antigen).[33] Memory B cells can be generated from T cell-dependent activation through both the extrafollicular response and the germinal center reaction as well as from T cell-independent activation of B1 cells.[33]
- B-2 cell – FO B cells and MZ B cells.[35]
- Follicular (FO) B Cell (also known as a B-2 cell) – Most common type of B cell and, when not circulating through the blood, is found mainly in the lymphoid follicles of secondary lymphoid organs (SLOs).[27] They are responsible for generating the majority of high-affinity antibodies during an infection.[30]
- Marginal zone (MZ) B cell – Found mainly in the marginal zone of the spleen and serves as a first line of defense against blood-borne pathogens, as the marginal zone receives large amounts of blood from the general circulation.[36] They can undergo both T cell-independent and T cell-dependent activation, but preferentially undergo T cell-independent activation.[27]
- B-1 cell – Arises from a developmental pathway different from FO B cells and MZ B cells.[35] In mice, they predominantly populate the peritoneal cavity and pleural cavity, generate natural antibodies (antibodies produced without infection), defend against mucosal pathogens, and primarily exhibit T cell-independent activation.[35] A true homologue of mouse B-1 cells has not been discovered in humans, though various cell populations similar to B-1 cells have been described.[35]
- Regulatory B (Breg) cell – An immunosuppressive B cell type that stops the expansion of pathogenic, pro-inflammatory lymphocytes through the secretion of IL-10, IL-35, and TGF-β.[37] Also, it promotes the generation of regulatory T (Treg) cells by directly interacting with T cells to skew their differentiation towards Tregs.[37] No common Breg cell identity has been described and many Breg cell subsets sharing regulatory functions have been found in both mice and humans.[37] It is currently unknown if Breg cell subsets are developmentally linked and how exactly differentiation into a Breg cell occurs.[37] There is evidence showing that nearly all B cell types can differentiate into a Breg cell through mechanisms involving inflammatory signals and BCR recognition.[37]
B cell-related pathology
խմբագրելAutoimmune disease can result from abnormal B cell recognition of self-antigens followed by the production of autoantibodies.[38] Autoimmune diseases where disease activity is correlated with B cell activity include scleroderma, multiple sclerosis, systemic lupus erythematosus, type 1 diabetes, post-infectious IBS, and rheumatoid arthritis.[38]
Malignant transformation of B cells and their precursors can cause a host of cancers, including chronic lymphocytic leukemia (CLL), acute lymphoblastic leukemia (ALL), hairy cell leukemia, follicular lymphoma, non-Hodgkin's lymphoma, Hodgkin's lymphoma, and plasma cell malignancies such as multiple myeloma, Waldenström's macroglobulinemia, and certain forms of amyloidosis.[39][40]
Epigenetics
խմբագրելA study that investigated the methylome of B cells along their differentiation cycle, using whole-genome bisulfite sequencing (WGBS), showed that there is a hypomethylation from the earliest stages to the most differentiated stages. The largest methylation difference is between the stages of germinal center B cells and memory B cells. Furthermore, this study showed that there is a similarity between B cell tumors and long-lived B cells in their DNA methylation signatures.[41]
See also
խմբագրելReferences
խմբագրել- ↑ 1,0 1,1 1,2 Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). «B Cells and Antibodies». Molecular Biology of the Cell. 4th edition (անգլերեն).
- ↑ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). «B Cells and Antibodies». Molecular Biology of the Cell. 4th edition (անգլերեն).
- ↑ 4,0 4,1 Cooper, Max D. (2015-01-01). «The early history of B cells». Nature Reviews Immunology. 15 (3): 191–7. doi:10.1038/nri3801. PMID 25656707.
- ↑ 5,0 5,1 Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ «Cell Fate Decisions: The Role of Transcription Factors in Early B-cell Development and Leukemia». Blood Cancer Discovery. 1: 224–233. November 2020. doi:10.1158/2643-3230.BCD-20-0011.
- ↑ 7,0 7,1 Kondo, Motonari (2010-11-01). «Lymphoid and myeloid lineage commitment in multipotent hematopoietic progenitors». Immunological Reviews. 238 (1): 37–46. doi:10.1111/j.1600-065X.2010.00963.x. ISSN 1600-065X. PMC 2975965. PMID 20969583.
- ↑ Pelanda, Roberta; Torres, Raul M. (2012-04-01). «Central B-Cell Tolerance: Where Selection Begins». Cold Spring Harbor Perspectives in Biology. 4 (4): a007146. doi:10.1101/cshperspect.a007146. ISSN 1943-0264. PMC 3312675. PMID 22378602.
- ↑ Martensson, Inga-Lill; Almqvist, Nina; Grimsholm, Ola; Bernardi, Angelina (2010). «The pre-B cell receptor checkpoint». FEBS Letters. 584 (12): 2572–9. doi:10.1016/j.febslet.2010.04.057. PMID 20420836.
- ↑ LeBien, Tucker W.; Tedder, Thomas F. (2008-09-01). «B lymphocytes: how they develop and function». Blood. 112 (5): 1570–1580. doi:10.1182/blood-2008-02-078071. ISSN 0006-4971. PMC 2518873. PMID 18725575.
- ↑ Martensson, Inga-Lill; Almqvist, Nina; Grimsholm, Ola; Bernardi, Angelina (2010). «The pre-B cell receptor checkpoint». FEBS Letters. 584 (12): 2572–9. doi:10.1016/j.febslet.2010.04.057. PMID 20420836. S2CID 43158480.
- ↑ 12,0 12,1 LeBien, Tucker W.; Tedder, Thomas F. (2008-09-01). «B lymphocytes: how they develop and function». Blood. 112 (5): 1570–1580. doi:10.1182/blood-2008-02-078071. ISSN 0006-4971. PMC 2518873. PMID 18725575.
- ↑ Pelanda, Roberta; Torres, Raul M. (2012-04-01). «Central B-Cell Tolerance: Where Selection Begins». Cold Spring Harbor Perspectives in Biology. 4 (4): a007146. doi:10.1101/cshperspect.a007146. ISSN 1943-0264. PMC 3312675. PMID 22378602.
- ↑ Loder, By Florienne; Mutschler, Bettina; Ray, Robert J.; Paige, Christopher J.; Sideras, Paschalis; Torres, Raul; Lamers, Marinus C.; Carsetti, Rita (1999-07-01). «B Cell Development in the Spleen Takes Place in Discrete Steps and Is Determined by the Quality of B Cell Receptor–Derived Signals». The Journal of Experimental Medicine. 190 (1): 75–90. doi:10.1084/jem.190.1.75. ISSN 0022-1007. PMC 2195560. PMID 10429672.
- ↑ 15,0 15,1 Chung, James B.; Silverman, Michael; Monroe, John G. (2003-01-06). «Transitional B cells: step by step towards immune competence». Trends in Immunology. 24 (6): 342–348. doi:10.1016/S1471-4906(03)00119-4. ISSN 1471-4906. PMID 12810111.
- ↑ Cerutti, Andrea; Cols, Montserrat; Puga, Irene (2013-01-01). «Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes». Nature Reviews Immunology. 13 (2): 118–32. doi:10.1038/nri3383. PMC 3652659. PMID 23348416.
- ↑ Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ Harwood, Naomi E.; Batista, Facundo D. (2010-01-01). «Early Events in B Cell Activation». Annual Review of Immunology. 28 (1): 185–210. doi:10.1146/annurev-immunol-030409-101216. PMID 20192804.
- ↑ Yuseff, Maria-Isabel; Pierobon, Paolo; Reversat, Anne; Lennon-Duménil, Ana-Maria (2013-01-01). «How B cells capture, process and present antigens: a crucial role for cell polarity». Nature Reviews Immunology. 13 (7): 475–86. doi:10.1038/nri3469. PMID 23797063.
- ↑ Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (2015-01-01). «The generation of antibody-secreting plasma cells». Nature Reviews Immunology. 15 (3): 160–71. doi:10.1038/nri3795. PMID 25698678.
- ↑ Asokan, Rengasamy; Banda, Nirmal K.; Szakonyi, Gerda; Chen, Xiaojiang S.; Holers, V. Michael (2013-01-01). «Human complement receptor 2 (CR2/CD21) as a receptor for DNA: Implications for its roles in the immune response and the pathogenesis of systemic lupus erythematosus (SLE)». Molecular Immunology. 53 (1–2): 99–110. doi:10.1016/j.molimm.2012.07.002. PMC 3439536. PMID 22885687.
- ↑ Zabel, Mark D.; Weis, John H. (2001-03-01). «Cell-specific regulation of the CD21 gene». International Immunopharmacology. Unraveling Mechanisms and Discovering Novel Roles for Complement. 1 (3): 483–493. doi:10.1016/S1567-5769(00)00046-1. PMID 11367532.
- ↑ 23,0 23,1 23,2 Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ Blum, Janice S.; Wearsch, Pamela A.; Cresswell, Peter (2013-01-01). «Pathways of Antigen Processing». Annual Review of Immunology. 31 (1): 443–473. doi:10.1146/annurev-immunol-032712-095910. PMC 4026165. PMID 23298205.
- ↑ 25,0 25,1 25,2 25,3 25,4 Crotty, Shane (2015-01-01). «A brief history of T cell help to B cells». Nature Reviews Immunology. 15 (3): 185–9. doi:10.1038/nri3803. PMC 4414089. PMID 25677493.
- ↑ Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ 27,0 27,1 27,2 27,3 27,4 27,5 27,6 27,7 27,8 Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (2015-01-01). «The generation of antibody-secreting plasma cells». Nature Reviews Immunology. 15 (3): 160–71. doi:10.1038/nri3795. PMID 25698678. S2CID 9769697.
- ↑ MacLennan, Ian C. M.; Toellner, Kai-Michael; Cunningham, Adam F.; Serre, Karine; Sze, Daniel M.-Y.; Zúñiga, Elina; Cook, Matthew C.; Vinuesa, Carola G. (2003-08-01). «Extrafollicular antibody responses». Immunological Reviews. 194: 8–18. doi:10.1034/j.1600-065x.2003.00058.x. ISSN 0105-2896. PMID 12846803.
- ↑ Shlomchik, Mark J.; Weisel, Florian (2012-05-01). «Germinal center selection and the development of memory B and plasma cells». Immunological Reviews. 247 (1): 52–63. doi:10.1111/j.1600-065X.2012.01124.x. ISSN 1600-065X. PMID 22500831.
- ↑ 30,0 30,1 30,2 30,3 30,4 30,5 30,6 30,7 30,8 Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
- ↑ 31,0 31,1 Bortnick, Alexandra; Chernova, Irene; Quinn, William J.; Mugnier, Monica; Cancro, Michael P.; Allman, David (2012-06-01). «Long-Lived Bone Marrow Plasma Cells Are Induced Early in Response to T Cell-Independent or T Cell-Dependent Antigens». The Journal of Immunology. 188 (11): 5389–5396. doi:10.4049/jimmunol.1102808. ISSN 0022-1767. PMC 4341991. PMID 22529295.
- ↑ 32,0 32,1 32,2 32,3 32,4 McHeyzer-Williams, Michael; Okitsu, Shinji; Wang, Nathaniel; McHeyzer-Williams, Louise (2011-01-01). «Molecular programming of B cell memory». Nature Reviews Immunology. 12 (1): 24–34. doi:10.1038/nri3128. PMC 3947622. PMID 22158414.
- ↑ 33,0 33,1 33,2 33,3 Kurosaki, Tomohiro; Kometani, Kohei; Ise, Wataru (2015-01-01). «Memory B cells». Nature Reviews Immunology. 15 (3): 149–59. doi:10.1038/nri3802. PMID 25677494. S2CID 20825732.
- ↑ Ribourtout B, Zandecki M (2015). «Plasma cell morphology in multiple myeloma and related disorders». Morphologie: Bulletin de l'Association des Anatomistes. 99 (325): 38–62. doi:10.1016/j.morpho.2015.02.001. PMID 25899140.
- ↑ 35,0 35,1 35,2 35,3 Baumgarth, Nicole (2010-01-01). «The double life of a B-1 cell: self-reactivity selects for protective effector functions». Nature Reviews Immunology. 11 (1): 34–46. doi:10.1038/nri2901. PMID 21151033. S2CID 23355423.
- ↑ Pillai, Shiv; Cariappa, Annaiah; Moran, Stewart T. (2005-01-01). «Marginal Zone B Cells». Annual Review of Immunology. 23 (1): 161–196. doi:10.1146/annurev.immunol.23.021704.115728. PMID 15771569.
- ↑ 37,0 37,1 37,2 37,3 37,4 Rosser, Elizabeth C.; Mauri, Claudia (2015). «Regulatory B Cells: Origin, Phenotype, and Function». Immunity. 42 (4): 607–612. doi:10.1016/j.immuni.2015.04.005. ISSN 1074-7613. PMID 25902480.
- ↑ 38,0 38,1 Yanaba, Koichi; Bouaziz, Jean-David; Matsushita, Takashi; Magro, Cynthia M.; St.Clair, E. William; Tedder, Thomas F. (2008-06-01). «B-lymphocyte contributions to human autoimmune disease». Immunological Reviews. 223 (1): 284–299. doi:10.1111/j.1600-065X.2008.00646.x. ISSN 1600-065X. PMID 18613843.
- ↑ III, Arthur L. Shaffer; Young, Ryan M.; Staudt, Louis M. (2012-01-01). «Pathogenesis of Human B Cell Lymphomas». Annual Review of Immunology. 30 (1): 565–610. doi:10.1146/annurev-immunol-020711-075027. PMC 7478144. PMID 22224767.
- ↑ Castillo JJ (2016). «Plasma Cell Disorders». Primary Care. 43 (4): 677–691. doi:10.1016/j.pop.2016.07.002. PMID 27866585.
- ↑ Kulis, Marta; Merkel, Angelika; Heath, Simon; Queirós, Ana C.; Schuyler, Ronald P.; Castellano, Giancarlo; Beekman, Renée; Raineri, Emanuele; Esteve, Anna (2015-07-01). «Whole-genome fingerprint of the DNA methylome during human B cell differentiation». Nature Genetics (անգլերեն). 47 (7): 746–756. doi:10.1038/ng.3291. ISSN 1061-4036. PMC 5444519. PMID 26053498.