Քիմիական կինետիկա
 Անվան այլ կիրառումների համար տե՛ս՝ Կինետիկա (այլ կիրառումներ)
Անվան այլ կիրառումների համար տե՛ս՝ Կինետիկա (այլ կիրառումներ)
Քիմիական կինետիկա, ֆիզիկական քիմիայի բաժիններից մեկը, որն ուսումնասիրում է քիմիական պրոցեսների արագությունները։ Քիմիական կինետիկան զբաղվում է ռեակցիայի մեխանիզմների և անցումային վիճակների ուսումնասիրությամբ, գնահատում է տարբեր գործոնների ազդեցությունը քիմիական ռեակցիայի արագության և ելքի վրա, ինչպես նաև կառուցում է մաթեմատիկական մոդելներ, որոնք բնութագրում են քիմիական ռեակցիաների ընթացքի օրինաչափությունները[1]։ 1864 թվականին երկու նորվեգացի քիմիկոսներ սկիզբ դրեցին քիմիական կինետիկայի զարգացմանը. նրանք ձևակերպեցին զանգվածների ազդման օրենքը, ըստ որի ռեակցիայի արագությունը ուղիղ համեմատական է ելանյութերի կոնցենտրացիաներին։
Քիմիական կինետիկան զբաղվում է ռեակցիաների արագությունների փորձնական որոշմամբ, որից էլ որոշվում է ռեակցիայի արագության կինետիկական հավասարումը և ռեակցիայի արագության հաստատունը։ Համեմատաբար պարզ տեսք ունեն զրոյական կարգի ռեակցիաների կինետիկական հավասարումները, որոնց համար ռեակցիայի արագությունը կախված չէ սկզբնանյութերի կոնցենտրացիաներից։ Լիմիտավորող փուլը որոշում է ռեակցիայի կինետիկան։ Առաջին կարգի ռեակցիաների համար կարելի է օգտագործել քվազիստացիոնառության սկզբունքը, որը կարող է պարզեցնել կինետիկական հավասարում։ Ռեակցիայի ակտիվացման էներգիան փորձնականորեն որոշվում է Էյրինգի և Արենիուսի հավասարումներով։
Ռեակցիայի արագության վրա ազդող գործոններ խմբագրել
Ելանյութերի բնույթ խմբագրել
Կախված փոխազդող նյութերի բնույթից ռեակցիայի արագությունները տարբերվում են։ Օրինակ՝ թթու/հիմք, աղերի առաջացման և իոնափոխանակման ռեակցիաները արագ են ընթանում, իսկ մեծ մոլեկուլների միջև կովալենտ կապերի առաջացման ռեակցիաները ընթանում են շատ դանդաղ։ Մոլեկուլում կապերի բնույթն ու ամրությունը էապես ազդում են ռեակցիայի արագության վրա։
Ֆիզիկական վիճակ խմբագրել
Ելանյութերի ֆիզիկական վիճակը (պինդ, հեղուկ կամ գազ) ևս ազդում է քիմիական ռեակցիայի արագության վրա։ Եթե ելանյութերը գտնվում են նույն ֆազում, ինչպես օրինակ ջրային լուծույթում, ապա ջերմային շարժումներ բերում ենք այդ մոլեկուլների բախմանը։ Եթե ելանյութերը գտնվում են տարբեր ֆազերում, ապա ռեակցիան սահմանափակված է այդ ֆազերը իրարից բաժանող տեղամասով։ Նմանատաիպ ռեակցիաները մինչև վերջ տանելու համար անհրաժեշտ է լինում ինտենսիվ թափահարել և խառնել լուծույթը (պինդ-հեղուկ ռեակցիայի համար)։
Կոնցենտրացիա խմբագրել
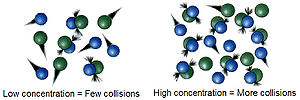
Ռեակցիաները տեղի են ունենում ելանյութերի մոլեկուլների բախումների հետևանքով։ Այդ բախումների հաճախությունը կախված է նրանց կոնցենտրացիայից։ Որքան կոնցենտրացիան մեծ լինի, անյքան ավելի հավանական կլինի մոլեկուլների բախումը տարածության մեջ։ Այսպիսով ելանյութերի կոնցենտրացիայի մեծացումը բերում է ռեակցիայի արագության մեծացմանը, իսկ կոնցենտրացիայի իջեցումը բերում է հակառակ ազդեցությանը։ Օրինակ՝ այրման ռեակցաիները, որոնք տեղի են ունենում օդում (21% թթվածին), կընթանան ավելի բուռն մաքուր թթվածնում։
Ճնշում խմբագրել
Գազային ռեակցիայում ճնշումը մեծացնելիս ելանյութերի բախումների հաճախությունը կմեծանա և ռեակցիան կընթանա ավելի արագ։ Պատճառն այն է, որ գազի ակտիվությունը ուղիղ համեմատական է գազի պարցիալ ճնշմանը։
Բացի այդ, ճնշման փոփոխության հետևանքով հնարավոր է նաև ռեակցիայի արագության գործակիցների փոփոխությունը։ Եթե իներտ գազ ավելացվի բարձրաջերմաստիճանային գազային ֆազում ընթացող ռեակցիոն խառնուրդին, ապա հնարավոր է ռեակցիայի արագության գործակիցների և վերջանյութերի փոփոխություն։ Այսպիսի ազդեցությունը կոչվում է քիմիական ակտիվացում։ Սա բացատրվում է այն հանգամանքով, որ էքզոթերմ և էնդոթերմ ռեակցիաները ընթանում են ավելի արագ, քան ջերմափոխանակությունը, որի հետևանքով ռեակցվող մոլեկուլները ձեռք են բերում ոչ ջերմային էներգիայի բաշխում (ոչ Բոլցմանյան բաշխում)։ Մեծացնելով ճնշումը, մեծանում է համակարգի և ռեակցվող նյութերի ջերմափոխանակությունը, որը նվազեցնում է այս ազդեցությունը։
Կոնդենսված ֆազերի մասնակցությամբ ռեակցիաներում համակարգի ճնշումը ևս ազդեցություն է ունենում։ Այդպիսի ազդեցությունները ուսումնասիրում են օգտագործելով ադամանդով լցված սալաքարեր։
Ռեակցիայի կինետիկան կարող է ուսումնասիրվել նաև ճնշման ցատկի միջոցով։ Այս մեթոդով կատարվում են ճնշման արագ փոփոխություններ և դիտում են հավասարակշռային համակարգին վերադառնալու ռելաքսացիայի ժամանակը։
Քիմիական ռեակցիայի կարգը խմբագրել
Քիմիական ռեակցիայի կարգը ըստ տվյալ նյութի ցույց է տալիս ռեակցիայի կինետիկական հավասարման մեջ տվյալ նյութի կոնցենտրացիայի ցուցիչը։
Զրոյական կարգի ռեակցիաներ խմբագրել
Կինետիկական հավասարումն ունի հետևյալ տեսքը
Զրոյական կարգի ռեակցիայի արագությունը կախված չէ ժամանակից, ելանյութերի կոնցենտրացիաներից և հաստատուն մեծություն է։ Զրոյական կարգի ռեակցիաներ բնորոշ են հետերոգեն ռեակցիաներին այն դեպքում, երբ ֆազերի բաժանման մակերևույթին ելանյութերի դիֆուզիայի արագությունը ավելի մեծ է, քան նրանց քիմիական փոխարկման արագությունը։
Առաջին կարգի ռեակցիաներ խմբագրել
Կինետիկական հավասարումն ունի հետևյալ տեսքը
Ձևափոխելով հավասարումը կստանանք
Ռեակցիայի արագության հաստատունը որոշվում է գրաֆիկական ճանապարհով
Կիսատրոհման պարբերությունը որոշվում է հետևյալ բանաձևով
Առաջին կարգի ռեակցիաներ են միջուկային ռեակցիաները։
Երկրորդ կարգի ռեակցիներ խմբագրել
Կինետիկական հավասարումն ունի հետևյալ տեսքը
կամ
Առաջին դեպքում ռեակցիայի արագությունը որոշվում է հետևյալ հավասարումով
Հավասարման գծային տեսքը
Ռեակցիայի արագության հաստատունը որոշվում է ինչպես գրաֆիկական, այնպես էլ հաշվարկային ճանապարհով
Երկրորդ դեպքի համար ռեակցիայի արագության հաստատունը որոշվում է հետևյալ հավասարումով
Կիսատրոհման պարբերությունը որոշվում է հետևյալ բանաձևով (հավասար կոնցենտրացիաներով ելանյութ(եր) ի դեպքում)
Տես նաև խմբագրել
Ծանոթագրություններ խմբագրել
Արտաքին հղումներ խմբագրել
- Chemistry applets Արխիվացված 2009-06-04 Wayback Machine
- University of Waterloo Արխիվացված 2005-11-24 Wayback Machine
- Գազաֆազ ռեակցիաների կինետիկան
- Kinpy: կինետիկական հավասարումները լուծելու Python կոդով գրված ծրագիր
| Վիքիպահեստ նախագծում կարող եք այս նյութի վերաբերյալ հավելյալ պատկերազարդում գտնել Քիմիական կինետիկա կատեգորիայում։ |