Միխաելիս-Մենթենի հավասարում
Միխաելիս-Մենթենի հավասարում, կենսաքիմիայում ֆերմենտատիվ ռեակցիաների կինետիկայի հիմնարար հավասարում։ Այն անվանվել է գերմանացի կենսաքիմիկոս Լեոնոր Միխաելիսի և կանադացի ֆիզիկոս Մոդ Մենթենի պատվին։ Այս հավասարումը իրենից ներկայացնում է ֆերմենտատիվ ռեակցիայի արագության կախվածությունը ռեակցիայի ելանյութի՝ սուբստրարի կոնցենտրացիայից։ Հիմնարար հավասարումը գրվում է հետևյալ կերպով
որտեղ՝
- - համակարգի հնարավոր առավելագույն արագություն,
- - Միխաելիսի հաստատուն, սուբստրատրի այն կոնցենտրացիան, որի դեպքում [1]։
Ընդունված է համարել, որ մեկ սուբստրատ պարունակով կենսաքիմիական ռեակցիաները ընթանում են Միխաելիս-Մենթենի առաջարկած մեխանիզմով։
Նախատիպ խմբագրել
1903 թվականին ֆրանսիացի ֆիզիկական քիմիկոս Վիկտոր Անրին հայտնաբերել է, որ ֆերմենտատիվ ռեակցիաները ուղեկցվում են ֆերմենտի և սուբստրարի միջև հատուկ կապերի առաջացմամբ[2]։ Նրա աշխատանքը հետագայում ուսումնասիրվել է գերմանացի կենսաքիմիկոս Լեոնոր Միխաելիսի և կանադացի ֆիզիկոս Մոդ Մենթենի կողմից, ովքեր հիմք են դրել ֆերմենտատիվ ռեակցիաների կինետիկային և առաջին անգամ հայտնաբերել են ինվերտազա ֆերմենտի ազդման մեխանիզմը, որով նա կատալիզում է սախարոզի հիդրոլիզը մինչև գլյուկոզ և ֆրուկտոզ[3]։ 1913 թվականին նրանք առաջարկեցին այս ռեակցիայի մաթեմատիկական մոդելը, որը հետագայում ընդլայնվեց և հիմք հանդիսացավ քիմիայի նոր բնագավառի զարգացմանը[4]։ Մեխանիզմն իր մեջ է ներառում էնզիմի կապումը սուբստրատի հետ, որի հետևանքով նախ առաջանում է էնզիմ-սուբստրատային կոմպլեքսը, որը հետագայում վերածվում է պրոդուկտի և էնզիմի։ Սխեմատիկորեն այս մեխանիզմը կարելի է պատկերել հետևյալ կերպով
- ,
որտեղ , և իրենցից ներկայացնում են համապատասխան ռեակցիաների արագության հաստատունները[5], իսկ -ի և -ի միջև կրկնակի սլաքը ցույց է տալիս, որ էնզիմի կապումը սուբստրատին դարձելի ռեակցիա է։
Որոշ մոտավորություններ անելուց հետո կարելի է ասել, որ պրոդուկտի առաջացման արագությունը տրվում է հետևյալ բանաձևով
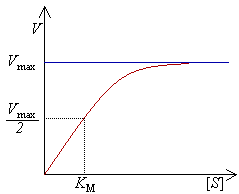
Ռեակցիայի արագությունը մեծանում և ձգտում է առավելագույն արժեքին (այն արագությունը, որի դեպքում ամբողջ էնզիմը կապվել է սուբստրատի հետ), երբ մեծանում է սուբստրատի կոնցենտրացիան ( )։ Ցույց է տրված նաև, որ , որտեղ - ֆերմենտի կոնցենտրացիան է, իսկ - սուբստրատի մոլեկուլների այն առավելագույն քանակը, որը վերածվել է պրոդուկտի միավոր ժամանակում և մեկ էնզիմի վրա հաշվարկած։
Միխաելիսի հաստատունը իրենից ներկայացնում է սուբստրատրի այն կոնցենտրացիան, որի դեպքում [1], բացի այդ, այն բնութագրում է սուբստրատի հակաաֆինությունը էնզիմի նկատմամբ (որքան փոքր է -ը, այնքան մեծ է աֆինությունը, հետևաբար արագությունը ավելի արագ կհասնի -ին[6])։ -ի արժեքը կախված է ինչպես էնզիմից և սուբստրատից, այնպես էլ ռեակցիայի կատարման պայմաններից (ջերմաստիճան, pH)։
Այս նախատիպը օգտագործվում է նաև բազմաթիվ այլ կենսաքիմիական ոլորտներում (հակածին-հակամարմին փոխազդեցություն, ԴՆԹ-ԴՆԹ հիբրիդացում, սպիտակուց-սպիտակուց փոխազդեցություն[6][7])։ Այն կարող է կիրառվել նաև ընդհանուր կենսաքիմիական ռեակցիաներ ուսումնասիրելիս, օրինակ՝ Լենգմյուրի հավասարման փոխարեն, որը թույլ է տալիս կազմել կենսաբանական օբյեկտների ադսորբցիայի մոդել կամ Մոնոդի հավասարման փոխարեն, որը թույլ է տալիս գնահատել մանրէի աճը[7]։
Միխաելիս-Մենթենի հավասարումը կիրառվում է ոչ միայն կենսաքիմիայում, այլ նաև բազմաթիվ այլ բնագավառներում (փոշու հատիկի ալվեոլային մաքրության որոշում[8], ջրավազանների կենդանական աշխարհի առատության որոշում[9], արյան մեջ ալկոհոլի քանակության որոշում[10], ֆոտոսինթեզ-ճառագայթում կախվածության որոշում[11], բակտերիալ վարակների ուսումնասիրություն[12])։
Կիրառություն խմբագրել
Ֆերմենտների պարամետրերը խստիվ տարբերվում են մեկը մյուսից[13]։
| Ֆերմենտ | (Մ) | (1/վ) | (1/Մ վ) |
|---|---|---|---|
| Խիմոտրիպսին | 1.5 × 10−2 | 0.14 | 9.3 |
| Պեպսին | 3.0 × 10−4 | 0.50 | 1.7 × 103 |
| Թիրոզիլ-փՌՆԹ սինթետազ | 9.0 × 10−4 | 7.6 | 8.4 × 103 |
| Ռիբոնուկլեազներ | 7.9 × 10−3 | 7.9 × 102 | 1.0 × 105 |
| Կարբոնատ դեհիդրազ | 2.6 × 10−2 | 4.0 × 105 | 1.5 × 107 |
| Ֆումարազ | 5.0 × 10−6 | 8.0 × 102 | 1.6 × 108 |
հաստատունը ցույց է տալիս, թե որքան է ֆերմենտի արդյունավետությունը սուբստրատին պրոդուկտ դարձնելու գործում։ Այն ունի մոտավոր վերին սահման (108 – 1010 /Մ վ)։ Այն ֆերմենտները, որոնք աշխատում են այդ տիրույթում (ֆումարազա), կոչվում են գերարդյունավետ[14]։
Կինետիկական բնութագիր խմբագրել
Դիտարկենք Միխաելիս-Մենթենի առաջարկած մեխանիզմը
Կիրառելով զանգվածների ներգործության օրենքը, որը պնդում է, որ ռեակցիայի արագությունը ուղիղ համեմատական է ելանյութերի կոնցենտրացիաների արտադրյալին, ստանում ենք չորս ոչ գծային դիֆերենցիալ հավասարումներ[15]։
Այս մեխանիզմում էնզիմը հանդիսանում է կատալիզատոր, որը միայն արագացնում է ռեակցիան, միաժամանակ նրա ամբողջ կոնցենտրացիան (կապված և ազատ ձևերի կոնցենտրացիաների գումարը՝ ) հաստատուն մեծություն է։ Այս հավասարությունը հնարավոր է ստանալ նաև գումարելով առաջին և երրորդ դիֆերենցիալ հավասարումները[15][16]։
Հավասարակշռային մոտավորություն խմբագրել
Իրականում Միխաելիսը և Մենթենը համարել են, որ սուբստրատը անմիջապես հավասարակշռության մեջ է մտնում կոմպլեքսի հետ և [4][16]։ Կիրառելով այս արտահայտությունը էնզիմի պահպանման օրենքի հետ համատեղ, ստանում ենք, որ կոմպլեքսի կոնցենտրացիան հավասար է[16]
- ,
որտեղ իրենից ներկայացնում է էնզիմ-սուբստրատային կոմպլեքսի դիսոցման հաստատունը։
Հետևաբար ռեակցիայի արագությունը ( պրոդուկտի առաջացման արագությունը) հավասար է[16]
- ,
որտեղ - ռեակցիայի առավելագույն արագությունն է։
Քվազիստացիոնար մոտավորություն խմբագրել
1925 թվականին բրիտանացի բուսաբան Ջորջ Էդվարդ Բրիգսը և բրիտանացի գենետիկ Հոլդեյնը առաջարկեցին այս մեխանիզմի մեկ այլ կինետիկական մեկնաբանություն[17]։ Նրանք համարեցին, որ միջանկյալ կոմպլեքսի (ինտերմեդիատի) կոնցենտրացիան չի փոխվում պրոդուկտի առաջացման ժամանակից կախված (քվազիստացիոնար մոտավորություն)։ Մաթեմատիկորեն այս մոտավորությունը կարելի է գրել հետևյալ կերպով
Կիրառելով այս արտահայտությունը էնզիմի պահպանման օրենքի հետ համատեղ, ստանում ենք, որ կոմպլեքսի կոնցենտրացիան հավասար է[16]
- ,
որտեղ և հայտնի է Միխաելիսի հաստատուն անվանմամբ,
և որտեղ , և համապատասխան ռեակցիաների արագության հաստատուններն են։
Հետևաբար ռեակցիայի արագությունը ( պրոդուկտի առաջացման արագությունը) հավասար է[16]
Մոտավորություններ և սահմանափակումներ խմբագրել
Առաջին մոտավորությունը կայանում է զանգվածների ներգործության օրենքի կիրառումը, քանի որ այն պահանջում է ազատ դիֆուզիա։ Պարզ է, որ կենդանի օրգանիզմի բջջում, որտեղ կա սպիտակուցների մեծ կոնցենտրացիա և, բացի այդ, ցիտոպլազման իրենից ներկայացնում է ավելի շուտ դոնդողանման, քան հեղուկ միջավայր, ապա մոլեկուլների շարժումները այդ միջավայրում խիստ սահմանափակված են[18]։ Քանի դեռ զանգվածների ներգործության օրենքը թույլ է տալիս այն կիրառել հետերոգեն համակարգերում[19], ապա նպատակահարմար կլինի ցիտոպլազման դիտել որպես ֆրակտալ[20]։
Երկու տարբեր մոտավորություններով ստացված ռեակցիայի արագությունները գրեթե նույնն են։ Տարբերությունը կայանում է նրանում, որ հավասարակշռային մոտավորությունը բերում է հաստատունին, իսկ քվազիստացիոնար մոտավորությունը՝ հաստատունին։ Միխաելիս-Մենթենի հավասարակշռային մոտավորությունը ճիշտ է կիրառել այն դեպքում, երբ սուբստրատը հասնում է հավասարակշիռ վիճակի ավելի շուտ, քան առաջանում է պրոդուկտը կամ ավելի ճիշտ[16], երբ
Բրիգս-Հոլդեյնի քվազիստացիոնար մոտավորությունը ճիշտ է կիրառել[15][21], երբ
Այսինքն այս մոտավորությունը տեղի ունի, եթե ֆերմենտի կոնցենտրացիան շատ փոքր է սուբստրատի կոնցենտրացիայից։ Եթե այս պահանջը բավարարված չէ, ապա հաստատունի մեծ արժեքները նույնպես ընդունելի պայման են հանդիսանում։
Ե՛վ Միխաելիս-Մենթենի, և՛ Բրիգս-Հոլդեյնի կատարած մոտավորությունները ավելի լավ տեսք են ընդունում, երբ -ը նվազում է[16]։
Շատ կարևոր պայման է նաև այն հանգամանքը, որ պետք է հաշվի առնել, որ ոչ մի ռեակցիա չի ընթանում մեկ ուղղությամբ։ Հետևաբար ֆերմենտատիվ ռեակցիայի մեխանիզմը ճիշտ կլինի գրել հետևյալ տեսքով
Իրականում, կարելի է համարել, որ ռեակցիան անդարձելի է, եթե պահպանվում է հետևյալ պայմաններից գոնե մեկը
1. Սուբստրատ(ներ) ի կոնցենտրացիան շատ մեծ է պրոդուկտ(ներ) ի կոնցենտրացիայից
Այս պայմանը ճիշտ է հատուկ in vitro և բազմաթիվ in vivo պայմաններում ընթացող կենսաբանական ռեակցիաների համար։
2. Ռեակցիայից անջատված էներգիան շատ մեծ է
Այն դեպքերում, երբ տեղի չունի հետևյալ երկու պայմաններից և ոչ մեկը, ապա սխալ է օգտագործել Միխաելիս-Մենթենի մոդելը։ Դրա փոխարեն կիրառում են ավելի բարդ մոդելավորման օրինակներ։
Հաստատունների որոշում խմբագրել
և հաստատունների որոշման համար դիտարկում են նույն ֆերմենտատիվ ռեակցիան սուբստրատի տարբեր սկզբնական կոնցենտրացիաների համար և սկզբից չափում են ֆերմենտատիվ ռեակցիայի սկզբնական արագությունը։ Սկզբնական ասելով նկատի ունեն, որ ռեակցիայի արագությունը չափվել է այն կարճ ժամանակում, երբ էնզիմ-սուբստրատային կոմպլեքս է գոյացել, և, բացի այդ, սուբստրատի կոնցենտրացիան մնացել է մոտավորապես հաստատուն[21]։ Ապա այդ հաստատունները կարելի է ստանալ կառուցելով ռեակցիայի արագության կախումը կոնցենտրացիայից արտահայտող գրաֆիկը[22]։
Նախքան համակարգչային մոդելավորման ի հայտ գալը կիրառվել են բազմաթիվ այլ հավասարումներ այդ հաստատունների որոշման համար (Էդի-Հոֆսթիի դիագրամ, Հան-Վուլֆի դիագրամ[22], Լայնովեր-Բերգի դիագրամ)։
1997 թվականին Սանտյագո Շնելը և Կլաուդիո Մենդոզան առաջարկեցին Միխաելիս-Մենթենի մեխանիզմի լուծման փակ մի եղանակ[23]։ Այժմ այն կրում է Շնել-Մենդոզայի հավասարում անվանումը և ունի հետևյալ տեսքը
- ,
որտեղ W[]՝ Լամբերտի W-ֆունկցիան է, իսկ F (t)-ն իրենից ներկայացնում է հետևյալ ֆունկցիան
Շնել-Մենդոզայի հավասարումը ներկայումս լայնորեն կիրառվում է ֆերմենտատիվ ռեակցիաների և հաստատունների որոշման համար[24][25]։
Ստորև տրված հավասարումը առաջարկվել է 2010 թվականին Մարիո Բարբերան-Սանթոսի կողմից և այն ևս լավ մոդել է ծառայում ռեակցիայի հաստատունների որոշման համար[26]։
Տես նաև խմբագրել
Ծանոթագրություններ խմբագրել
- ↑ 1,0 1,1 Introduction to Enzymes(անգլ.)
- ↑ Henri, Victor (1903), Lois Générales de l’Action des Diastases. Paris: Hermann. Google books(անգլ.)
- ↑ Վիկտոր Անրիի կենսագրություն(անգլ.)
- ↑ 4,0 4,1 Michaelis, L.; Menten, M.L. (1913). "Die Kinetik der Invertinwirkung". Biochem Z 49: 333–369
- ↑ Chen, W.W.; Neipel, M.; Sorger, P.K. (2010)(անգլ.)
- ↑ 6,0 6,1 Lehninger, A.L.; Nelson, D.L.; Cox, M.M. (2005). Lehninger principles of biochemistry. New York: W.H. Freeman
- ↑ 7,0 7,1 Chakraborty, S. (23 Dec 2009). Microfluidics and Microfabrication (1 ed.). Springer.
- ↑ Chen, W.W.; Neipel, M.; Sorger, P.K. (2010). "Classic and contemporary approaches to modeling biochemical reactions". Genes Dev 24 (17): 1861–1875.
- ↑ Yu, R.C.; Rappaport, S.M. (1997). "A lung retention model based on Michaelis–Menten-like kinetics". Environ Health Perspect 105 (5): 496–503.
- ↑ Keating, K.A.; Quinn, J.F. (1998). "Estimating species richness: the Michaelis–Menten model revisited". Oikos 81 (2): 411–416.
- ↑ Jones, A.W. (2010). "Evidence-based survey of the elimination rates of ethanol from blood with applications in forensic casework". Forensic Sci Int 200 (1–3): 1–20.
- ↑ Abedon, S.T. (2009). "Kinetics of phage-mediated biocontrol of bacteria". Foodborne Pathog Dis 6 (7): 807–15.
- ↑ Mathews, C.K.; van Holde, K.E.; Ahern, K.G. (10 Dec 1999). Biochemistry (3 ed.). Prentice Hall
- ↑ Stroppolo, M.E.; Falconi, M.; Caccuri, A.M.; Desideri, A. (Sep 2001). "Superefficient enzymes". Cell Mol Life Sci 58 (10): 1451–60.
- ↑ 15,0 15,1 15,2 Murray, J.D. (2002). Mathematical Biology: I. An Introduction (3 ed.). Springer.
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 16,6 16,7 Keener, J.; Sneyd, J. (2008). Mathematical Physiology: I: Cellular Physiology (2 ed.). Springer
- ↑ A Note on the Kinetics of Enzyme Action(անգլ.)
- ↑ Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences(անգլ.)
- ↑ Grima, R.; Schnell, S. (Oct 2006). "A systematic investigation of the rate laws valid in intracellular environments". Biophys Chem 124 (1): 1–10.
- ↑ Schnell, S.; Turner, T.E. (2004). "Reaction kinetics in intracellular environments with macromolecular crowding: simulations and rate laws". Prog Biophys Mol Biol 85 (2–3): 235–60.
- ↑ 21,0 21,1 Segel, L.A.; Slemrod, M. (1989). "The quasi-steady-state assumption: A case study in perturbation". Thermochim Acta 31 (3): 446–477.
- ↑ 22,0 22,1 Leskovac, V. (2003). Comprehensive enzyme kinetics. New York
- ↑ Schnell, S.; Mendoza, C. (1997). «A closed form solution for time-dependent enzyme kinetics». Journal of Theoretical Biology. 187: 207–212. doi:10.1006/jtbi.1997.0425.(անգլ.)
- ↑ Goudar, C. T.; Sonnad, J. R.; Duggleby, R. G. (1999). «Parameter estimation using a direct solution of the integrated Michaelis–Menten equation». Biochimica et Biophysica Acta – Protein Structure and Molecular Enzymology. 1429: 377–383.(անգլ.)
- ↑ Goudar, C. T.; Harris, S. K.; McInerney, M. J.; Suflita, J. M. (2004). «Progress curve analysis for enzyme and microbial kinetic reactions using explicit solutions based on the Lambert W function». Journal of Microbiological Methods. 59 (3): 317–326. doi:10.1016/j.mimet.2004.06.013.(անգլ.)
- ↑ Berberan–Santos, M. N. (2010). «A General Treatment of Henri–Michaelis–Menten Enzyme Kinetics: Exact Series Solution and Approximate Analytical Solutions». MATCH Commun. Math. Comput. Chem. 63 (2): 283–318.(անգլ.)

![{\displaystyle [S]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/292bbb82029aa583c5d2ac5fa1d7e4fedf537d8b)
![{\displaystyle v={\frac {d[P]}{dt}}={\frac {V_{\max }{[S]}}{K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f731622e289e840762104d468ef182a275c8f956)


