ԴՆԹ միկրոչիփ
ԴՆԹ միկրոչիփ (անգլ.՝ DNA microarray), տեխնոլոգիա` օգտագործվող մոլեկուլային կենսաբանությունում և բժշկության մեջ։ Ժամանակակից ԴՆԹ-միկրոչիփը կազմված է հազարավոր դեզօքսիօլիգոնուկլոտիդներից` զոնդերից, խմբավորված միկրոսկոպիկ կետերի տեսքով և ամրացված պինդ տակդիրի վրա։ Յուրաքանչյուր կետ պարունակում է մի քանի պիկոմոլ ԴՆԹ` որոշակի նուկլեոտիդային հաջորդականությամբ։
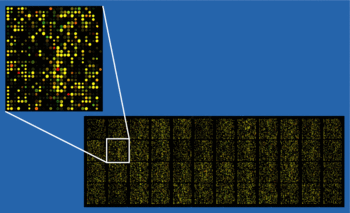
ԴՆԹ միկրոչիփի օլիգոնուկլեոտիդները կարող են լինել գեների կամ ԴՆԹի այլ ֆուկցիոնալ տարրերի կարճ հատվածներ և օգտագործվում են կոմպլեմենտար ԴՆԹի (կ-ԴՆԹ) կամ մ-ՌՆԹի (կՌՆԹ) հետ հիբրիդացման համար։ Զոնդի և թիրախի հիբրիդացումը գրանցվում է և քանակապես բնութագրվում ֆլուորեսցենցիայի կամ հեմիլյումինեսցենցիայի օգնությամբ, որը թույլ է տալիս որոշել նմուշում տրված հաջորդականությամբ նուկլեինաթթուների հարաբերական քանակությունը։
Սովորական ԴՆԹ-միկրոչիփում զոնդերը կովալենտ ամրացվում են պինդ մակերևույթին` ապակյա կամ սիլիցիումային չիփին։ Մյուս հարթակները, օրինակ` Illumina-ի արտադրածները, օգտագործում են միկրոսկոպիկ գնդիկներ մեծ պինդ մակերևույթների փոխարեն։
ԴՆԹ միկրոչիփերը օգտագործում են գեների էքսպրեսիայի փոփոխության վերլուծության, օլիգոնուկլոտիդային պոլիմորֆիզմի բացահայտման, գենատիպավորման կամ մուտանտային գենոմների կրկվող սեքվենավորման համար։
Միկրոչիփերը տարբերվում են իրենց դիզայնով, աշխատանքի յուրահատկություններով, ճշգրտությամբ, արդյունավետությամբ և արժեքով։
Պատմություն խմբագրել
ԴՆԹ-ի միկրոչիփերի տեխնոլոգիան սկիզբ է առնում Southern blot-ից`մեթոդիկայից, որում ֆրագմենտավորված ԴՆԹ-ն տեղափոխում են համապատասխան կրիչի վրա և հետո հայտնի նուկլոտիդային հաջորդականությամբ զոնդի օգնությամբ որոշում են նմուշում նպատակային հաջորդականության բաղադրությունը։
Առաջին անգամ տարատեսակ ԴՆԹ-ների հավաքածուն ` միավորված չիփում, օգտագործվել է 1987-ին ինտերֆերոններով գեների էքսպրեսիայի կարգավորման յուրահատկությունների բացահայտման ժամանակ[1]։
Սկզբնական ԴՆԹ-միկրոչիփերը պատրաստվում էին ֆիլտրի թղթի վրա կԴՆԹի միկրոքանակությունների «կաթեցմամբ» :Գեների էքսպրեսիայի յուրահատկությունների որոշման համար մանրակերտ չիփերի օգտագործումը, իրագործվել է 1995թ-ին[2] և ամբողջական էուկարիոտ գենոմը (Saccharomyces cerevisiae) միկրոչիփի վրա է տեղադրվել 1997 թ-ին[3]։
Միկրոչիփերի տեսակները խմբագրել
Printed (spotted) microarrays խմբագրել
Այս ԴՆԹ-միկրոչիփերում զոնդերը պատրաստվել էին օլիգոնուկլոտիդների քիմիական սինթեզի միջոցով և հետո ամրացվել են մասիվի տարրերին։ Զոնդերը, տեղադրվել են ասեղով ` նախապես տակդիրի վրա որոշված կետեր վրա կամ տպագրվում էին տակդիրի փոքր ցանցի վրա տպիչով, որը օգտագործում էր նույն տպագրության տեխնոլոգիան, ինչ և շիթային տպիչը , բայց թանաքի կաթիլների փոխարեն օգտագործվել էին նանո- կամ պիկո- ծավալներով պրոբերի կաթիլներ[4][5]։
In-situ synthesized խմբագրել
Այսպիսի միկրոչիփերը ստեղծվել են ֆոտոլիթոգրաֆիայի օգտագործմամբ։ Գործընթացն այսպիսին է, տակդիրի վրա գտնվում են կովալենտալին լինք-մոլեկուլներ՝ պաշտպանիչ խմբով ազատ ծայրին, որը կարող է հեռացվել լույսով։ ՈւՄ–լույսը ուղղորդվում է ֆոտոլիթոգրաֆիկ դիմակի միջով, հեռացնում է պաշտպանությունը և ակտիվացնում է ընտրված հիդրօքսիլ խմբերով սայթերը , որոնք սկզբնավորում են շղթայակցումը պաշտպանված նուկլեոտիդների հետ, որոնք ամրացվում են ակտիվացված սայթերին։ Դիմակը մշակված է այնպես, որ կարելի է ընտրել էքսպոզիցիայի սայթերը և այդպիսով որոշել զանգվածում կոորդինատները, որոնց վրա նուկլեոտիդը պետք է ամրացվի։
Գործընթացը կրկնվում է, օգտագործվում է նոր դիմակ, ակտիվացնում սայթերի տարբեր հավաքներ և տարբեր հիմքեր` թույլ տալով անհրաժեշտ ԴՆԹ-նմուշներին սինթեզվել ամեն մի սայթի վրա։
Սինթեզի ամեն մի փուլի ժամանակ չիփի վրայի յուրաքանչյուր նմուշ պահանջում է 4 դիմակ. 1 դիմակը` սինթեզի համար և 3-ը, որպեսզի կանխվի պաշտպանության վերացումը այն տեղում և այն ժամանակ, երբ ավելացվում են 3 այլ նուկլոտիդներ։ Միջինը, 25 նուկլեոտիդ երկարությամբ ամեն մի նմուշ պահանջում է չիփի վրա 100 դիմակ։ Այդպիսի միկրոչիփերը, որպես կանոն, օգտագործում են մի քանի նմուշ ամեն մի գենի համար ` մենահատկությունը մեծացնելու և սնիպերի փնտրման համար[4][5]։
High-density bead arrays խմբագրել
Illumina BeadArray Արխիվացված 2013-01-05 Wayback Machine տեխնոլոգիան հիմնված է գունակոդավորված 3-մկմ քվարցային հատիկներից, որոնք պատահական կերպով տեղաբաշխված են քվարցե ապակուց կամ թելաօպտիկ խրձերից սլայդի վրա։ Հատկիները գտնվում են իրարից 5.7 մկմ հեռավորության վրա և այդպիսով ապահովվում է ամեն քառակուսի միլիմետրի վրա 40000 էլեմենտ մասիվի խտություն։ Ամեն մի հատիկ պատված է հարյուր հազարավոր մենահատուկ օլիգոնուկլեոտիդային հաջորդականությունների պատճեններով , որոնց հետ հիբրիդացվում է վերլուծվող հաջորդականությունը։ Յուրաքանչյուր գնդիկ ունի 23 օլիգոնուկլեոտիդներից կազմված հասցե և զոնդ 50 օլիգոնուկլեոտիդ երկարությամբ։
Մասիվի արտադրության պրոցեսում հատիկները տեղաբաշխվում են սուբստրատում պատահականորեն այնպես, որ ամեն մի մասիվին բաժին է ընկնում 50000 հատիկ:Ամեն մի գեն ներկայացված է զոնդերի երկու հաջորդականություններով.: Ապակոդավորող հիբրիդացման սերիան օգտագործվում է որոշելու համար , թե ամեն մի մասիվի համար որ օլիգոնուկլեոտիդները որ կոորդինատներում են առկա[4][5]։
BeadArray-ի ապակոդավորումը խմբագրել
Մասիվի ապակե գնդիկները ունեն իրենց հասցեները։ Հասցեն կազմված է ֆլուորեսցենտ նշված օլգոնուկլեոտիդնեի հաջորդականություններից, որոնցից ամեն մեկը կարող է ունենալ երեք արժեք` 0 (OFF), 1 (ON — FAM), 2 (ON —Cy3): Ամենահաճախ սխալները լինում են ON-ի վիճակներց մեկից OFF վիճակին անցման ժամանակ, իսկ ավելի հազվադեպ` OFF-ից դեպի ON վիճակի ժամանակ։ ON-ի մի վիճակից ուրիշ վիճակի անցման ժամանակ սխալները ամենահազվադեպն են, քանի որ նրանք երկու սխալների համադրում են, մեկ կանալում ON-ի մի վիճակի սխալ ճանաչումը և միևնույն ժամանակ ON-ի ազդանշանի սխալ ճանաչումը որպես OFF ազդանշան։ Կորեկտության ստուգման համար օգտագործվում է Հեմինգի կոդի նման կոդ։ Օրինակ ` 8 օլիգոնուկլեոտիդային հասցեի համար վերծանված հասցեում պետք է լինի ON-ի վեց վիճակ և и OFF-ի` երկու։ Այսպիսով գոյություն ունի1520 կորեկտ և օգտագործվող հասցեներ, 272 կորեկտ, բայց չօգտագործվող հասցեներ (նրանք օգտագործվում են հազվադեպ պատահող կրկնակի սխալների ճանաչման համար) և 4769 ոչ կորեկտ հասցեներ[6]։
Ծանոթագրություններ խմբագրել
- ↑ Kulesh DA, Clive DR, Zarlenga DS, Greene JJ (1987). «Identification of interferon-modulated proliferation-related cDNA sequences». Proc Natl Acad Sci USA. 84: 8453–8457. doi:10.1073/pnas.84.23.8453. PMID 2446323.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Schena M, Shalon D, Davis RW, Brown PO (1995). «Quantitative monitoring of gene expression patterns with a complementary DNA microarray». Science. 270: 467–470. doi:10.1126/science.270.5235.467. PMID 7569999.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ Lashkari DA, DeRisi JL, McCusker JH, Namath AF, Gentile C, Hwang SY, Brown PO, Davis RW (1997). «Yeast microarrays for genome wide parallel genetic and gene expression analysis». Proc Natl Acad Sci USA. 94: 13057–13062. doi:10.1073/pnas.94.24.13057. PMID 9371799.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 4,0 4,1 4,2 Miller, M. B., & Tang, Y.-W. (2009). «Basic concepts of microarrays and potential applications in clinical microbiology». Clinical Microbiology Reviews. 22(4): 611–633. doi:10.1128/CMR.00019-09.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link) - ↑ 5,0 5,1 5,2 How DNA Microarrays are Built
- ↑ Gunderson, K. L., Kruglyak, S., Graige, M. S., Garcia, F., Kermani, B. G., Zhao, C., … Chee, M. S. (2004). «Decoding randomly ordered DNA arrays». Genome Research. 14(5): 870–877. doi:10.1101/gr.2255804.
{{cite journal}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)