Բերանի խոռոչի քաղցկեղ
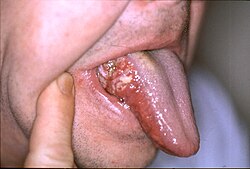
Բերանի խոռոչի քաղցկեղ` քաղցկեղի տեսակ է,որն ախտահարում է բերանի խոռոչը, շուրթերը կամ ըմպանը/կոկորդի վերին հատվածը[1]։ Բերանի խոռոչի ախտահարումը սովորաբար սկսվում է անցավ սպիտակ բծից՝ լեյկոպլակիայից, որը գնալով հաստանում է, ձևավորվում են կարմիր բծեր, խոց, որը շարունակում է աճել։ Շուրթերին տեղակայվելու դեպքում այն սովորաբար ունի մշտական կեղևով պատված դանդաղ մեծացող խոցի տեսք, որը չի լավանում[2]։ Այլ ախտանշաններից են՝ դժվար կամ ցավոտ կլման ակտը, պարանոցի շրջանում նոր գոյացությունների, բշտիկների առկայությունը, բերանի այտուցը կամ բերանի, շուրթերի շրջանում թմրածության զգացողությունը[3]։
| Բերանի խոռոչի քաղցկեղ | |
|---|---|
 | |
| Տեսակ | հիվանդության կարգ |
| Բժշկական մասնագիտություն | ուռուցքաբանություն և oral and maxillofacial surgery? |
Ռիսկի գործոններից են ծխելը և ալկոհոլի օգտագործումը[4][5]։ Միաժամանակ ծխախոտ և ալկոհոլ օգտագործողների մոտ բերանի խոռոչի քաղցկեղի առաջացման վտանգը 15 անգամ ավելի բարձր է[6]։ Բերանի խոռոչի քաղցկեղի առաջացման ռիսկի այլ գործոններից են՝ ՄՊՎ[7], պաննի (անգ․ pann) ծամելը[8] և արևի ճառագայթների ազդեցությունը ստորին շրթունքի վրա[9]։ Բերանի խոռոչի քաղցկեղը գլխի և պարանոցի քղցկեղների ենթատեսակ է[1]։ Ախտորոշումը կատարվում է բիոպսիայի միջոցով, որին հաջորդում են այլ հետազոտություններ՝ Համակարգչային Շերտագրությունը (ՀՇ), Մագնիսառեզոնանսային Շերտագրությունը , Պոզիտրոն էմիսիոն Շերտագրությունը և այլ հետազոտություններ որոնք օգնում են պարզել, թե արդյոք քաղցկեղը տարածվել է մարմնի այլ հատվածներում։
Հիվանդությունը կարելի է կանխել խուսափելով ծխախոտի, ալկոհոլի,պաննի օգտագործումից, ինչպես նաև ՄՊՎ-ի դեմ պատվաստումով և արևի ուղղակի ճառագայթներից ստորին շրթունքի պաշտմանման միջոցով։ Բուժումը մուլտիդիսցիպլինար է՝ կարող է ներառել վիրաբուժական միջամտություն (ուռուցքի և պարանոցի շրջանի ախտահարված լիմֆատիկ հանգույցների հեռացման նպատակով), ճառագայթային բուժում, քիմիոթերապիա կամ թիրախային թերապիա։ Բուժման տեսակը կախված է ուռուցքի մեծությունից, տեղակայումից, տարածվածությունից և բուժառուի ընդհանուր առողջական վիճակից[2]։
2018 թվականին ամբողջ աշխարհում դիտվել է բերանի խոռոչի քաղցկեղի մոտ 355,000 դեպք, որից 177,000 մահվան ելքով[10]։ 1999-ից 2015 թվականն ընկած ժամանակահատվածում Միացյալ Նահանգներում բերանի խոռոչի քաղցկեղի տարածվածությունն աճել է 6%-ով (10,9-ից հասնելով 11,6-ի՝ 100000-ից)։ Այս ընթացքում բերանի խոռոչի քաղցկեղով պայմանավորված մահացությունը նվազել է 7%-ով ( 2,7-ից հասնելով 2,5-ի՝100000-ից )[11]։ 2015 թվականի տվյալներով Միացյալ Նահանգներում բերանի խոռոչի քաղցկեղ ունեցողների ապրելիությունը 65% է 5 տարվա կտրվածքով[12]։ Ապրելիության տոկոսը կարող է փոփոխվել։ Այն կարող է հասնել 84%-ի, եթե քաղցկեղն ախտորոշվել է ժամանակին և դեռ ունի տեղային բնույթ կամ 66%-ի, եթե մետաստազներ կան պարանոցի ավշային հանգույցներում և 39%-ի, եթե այն տարածվել է մարմնի այլ հատվածներ/ծայրամասեր[12]։ Դրական ելքը կախված է նաև բերանի խոռոչում ուռուցքի տեղակայումից[13]։
Ախտանիշները և ախտանշանները խմբագրել
Բերանի խոռոչի քաղցկեղի նշաններն ու ախտանշանները կախված են ուռուցքի տեղակայումից։ Ընդհանուր առմամբ հանդիպում են բարակ, անկանոն, սպիտակ բծերի տեսքով։ Կարող են դիտվել նաև կարմիր և սպիտակ բծերի խառնուրդներ։ Դասական նախազգուշացնող ախտանշանը մշտական, նվազագույն ցավով կոպիտ բիծն է խոցոտումներով և բարձրացած եզրագծով։ Շրթունքների վրա խոցը ավելի հաճախ կեղևավորված է և չոր, իսկ ըմպանում այն ավելի հաճախ զանգվածային է։ Հավելյալ ախտանշաններ կարող են դիտվել նաև՝ սպիտակ շերտի, շարժվող ատամների առկայությունը, լնդերի արյունահոսությունը, մշտական ականջի ցավը, շրթերիերի և կզակի թմրածությունը կամ այտուցը[14]։
Դեպի կոկորդ տարածվելու դեպքում կարող է դիտվել դժվարացած կլլման ակտ (սովորաբար լեզվի HPV16+ քաղցկեղի հիմքում) կամ միակողմանի նկատելի մեծացած նշագեղձը[15], ցավոտ կլլում և ձայնի փոփոխություն[16]։ Որպես կանոն, ախտահարումները քիչ ցավոտ են, քանի դեռ չեն մեծացել և չկա այրման զգացողություն[17]։ Դեպի պարանոցի ավշային հանգույցներ տարածման դեպքում կզարգանա անցավ, կոշտ զանգված։ Մարմնի այլ հատվածներ տարածվելու ժամանակ կարող է դիտվել ընդհանուր ցավ, ինչն առավելի հաճախ պայմանավորված է ոսկրային մետաստազներով (bone metastasis)[17]։
Պատճառները խմբագրել
Բերանի խոռոչի տափակ բջջային քաղցկեղը արտաքին միջավայրի գործոններով պայմանավորված հիվանդություն է։ Այդ գործոններից ամնեակարևորը ծխախոտն է։ Ինչպես շրջակա միջավայրի այլ գործոնների դեպքում այնպես էլ այստեղ, քաղցկեղի զարգացման արագությունը կախված է քաղցկեղածին գործոնի (քաղցկեղն առաջացնող գործոնի) չափաբաժնից, հաճախականությունից և կիրառման եղանակից[18]։ Բացի ծխախոտից, բերանի խոռոչի քաղցկեղի առաջացման այլ քաղցկեղածին գործոններն են՝ ալկոհոլը, վիրուսները (մասնավորապես՝ ՄՊՎ 16 և 18), ճառագայթումը և ուլտրամանուշակագույն ճառագայթները[2]։
Ծխախոտ խմբագրել
Ծխախոտը առանձին վերցրած բերանի խոռոչի և ըմպանի քաղցկեղի ձևավորման ամենագլխավոր պատճառն է։ Այն հայտնի է որպես տարբեր օրգան համակարգերի վրա ազդող քաղցկեղածին գործոն, որն ունի սիներգետիկ փոխազդեցություն ալկոհոլի հետ՝ առաջացնելով բերանի խոռոչի և կոկորդի քաղցկեղ՝ ուղղակիորեն վնասելով բջջային ԴՆԹ-ն[18]։ Համարվում է, որ ծխախոտը մեծացնում է բերանի խոռոչի քաղցկեղի առաջացման վտանգը 3,4[18]-6.8[4] և պատասխանատու է բերանի խոռոչի բոլոր քաղցկեղների մոտավորապես 40%-ի առաջացման համար[19]։
Ալկոհոլ խմբագրել
Ավստրալիայում, Բրազիլիայում և Գերմանիայում իրականացված որոշ հետազոտություններ ցույց են տվել, որ ալկոհոլ պարունակող բերանի խոռոչի ողողման հեղուկները նույնպես ռիսկի պոտենցիալ գործոններ են։ Հետազոտության արդյունքում եկել են այն եզրահանգման, որ ալկոհոլ պարունակող ողողման հեղուկների մշտական օգտագործումը, նույնիսկ ծխելու և խմելու բացակայության դեպքում, հանգեցնում է բերանի խոռոչի քաղցկեղի զարգացման զգալի աճի։ Այնուամնայնիվ 1985[20], 1995[21] և 2003[22] թվականներին կատարված հետազոտությունների արդյունքում եկել են այն եզրահանգման,որ ալկոհոլ պարունակող բերանի խոռոչի ողողման հեղուկները չեն առաջացնում բերանի խոռոչի քաղցկեղ։ Ըստ Ամերիկայի Ատամնաբույժների Ասոցիացիայի 2009 թվականի մարտի ամփոփագրի՝ «առկա տվյալները չեն հաստատում կապը բերանի խոռոչի քաղցկեղի և ալկոհոլ պարունակող ողողման հեղուկների միջև»[23]։ 2008 թվականին արված հետազոտության արդյունքում պարզվել է, որ ացետալդեհիդը (ալկոհոլի քայքայման արգասիք) կապված է բերանի խոռոչի քաղցկեղի առաջացման հետ[24][25], սակայն ուսումնասիրությունը մասնավորապես արվել է ալկոհոլը չարաշահողների շրջանում և ոչ մի հղում չի տվել բերանի լվացմանը։
Մարդու Պապիլոմա Վիրուս խմբագրել
Մարդու պապիլոմա վիրուսը, մասնավորապես տիպի 16-ով պայմանավորված (կան ավելի քան 180 տեսակներ) բերանի խոռոչի քաղցկեղի առաջացման ռիսկի գործոն է[26]։ Նման ախտորոշում ունեցող արագ աճող մի ստվար զանգվածի մոտ նկատվում են շեղումներ պատմականորեն ընդունված դեմոգրաֆիկ/ժողովրդական տվյալներից։ Այն է՝ պատմականորեն ընդունված է համարել, որ հիմնականում հիվանդանում են 50 տարեկանից բարձր մարդիկ, հիվանդությունը սևամորթների մոտ ավելի հաճախ է դիտվում քան սպիտակամորթների մոտ (2-ից 1ը), տղամարդիկ ավելի հաճախ են ախտահարվում ի տարբերություն կանանց (3-ից 1ը) և ախտահարումը 75% դեպքերում դիտվում է նրանց մոտ ովքեր ստաբիլ օգտագործել են ծխախոտ կամ ալկոհոլ։ Ի տարբերություն վերոնշյալի այս նոր և արագ աճող ենթապոպոպուլյացիայի մոտ ախտանշանները հետևյալն են՝ տարիքը տատանվում է 30-ից 50-ի սահմաններում[27],դիտվոիմ է հիմնականում չծխողների, սպիտակամորթների մոտ և ախտահարված արական սեռի ներկայացուցիչների քանակը շատ քիչ է գերազանցում իգականին։ Բազմաթիվ ամսագրերի վերջին հետազոտությունները ցույց են տալիս, որ HPV16-ը բերանի խոռոչի քաղցկեղով հիվանդ մարդկանց այս նոր պոպուլյացիայի ռիսկի առաջնային գործոնն է։ HPV16-ը (HPV18-ի հետ միասին) նույն վիրուսն է, որը պատասխանատու է արգանդի վզիկի քաղցկեղի դեպքերի ճնշող մեծամասնության համար և ԱՄՆ-ում սեռական ճանապարհով փոխանցվող ամենատարածված վարակն է։ Այս տիպով պայմանավորված բերանի խոռոչի քաղցկեղը բարենպաստ է նշիկներիի և նշիկային աղեղների, լեզվի հիմքին և օրոֆարինքսի նկատմամբ։ Վերջին տվյալները ցույց են տալիս, որ այս տիպով հիվանդացածներնի մոտ ապրելիության տոկոսը բավականին բարձր է[28], քանի որ այս հիվանդությունն ավելի լավ է արձագանքում ճառագայթային բուժմանն, ի տարբերություն ծխախոտով պայմանավորվածին։
Բեթլ խմբագրել
Հայտնի է, որ բեթլ, պաան և արեկա ծամելը բերանի խոռոչի քաղցկեղի զարգացման ռիսկի խիստ գործոն է, անգամ ծխախոտի օգտագործման բացակայության դեպքում։ Այն 2,1 անգամ մեծացնում է բերանի խոռոչի քաղցկեղի առաջացման վտանգը՝ գենետիկական և մի շարք այլ գործոնների միջոցով՝ լորձաթաղանթի բջիջների տեղային գրգռում, մասնավորապես՝ արեկա ընկույզից և կրաքարից[18]։ Հնդկաստանում, որտեղ նման պրակտիկան տարածված է, բերանի խոռոչի քաղցկեղը կազմում է բոլոր քաղցկեղների մինչև 40%-ը, մինչդեռ Միացյալ Թագավորությունում այն կազմում է ընդամենը 4%-ը։
Ցողունային բջիջների փոխպատվաստում խմբագրել
Արյունաստեղծ ցողունային բջիջների փոխպատվաստում անցած մարդկանց մոտ բերանի խոռոչի տափակ բջջային քաղցկեղի առաջացման ռիսկն ավելի բարձր է։ Ցողունային բջիջների փոխպատվաստումից հետո բերանի խոռոչի քաղցկեղը կարող է ունենալ ավելի ագրեսիվ դրսևորում և վատ ելք ի համեմատ բերանի խոռոչի քաղցկեղ ունեցող այլ անձանաց հետ ովքեր չեն անցել ցողունային բջիջների փոխպատվաստում[29]։ Այս երևույթը կարող է պայմանավորված լինել երկար ժամանակ իմունիտետի ճնշմամբ և տրանսպլանտատ ընդդեմ տիրոջ համախտանիշով[29]։
Նախաքաղցկեղային հիվանդություններ խմբագրել
Նախաքաղցկեղային հիվնադություններ ասելով հասկանում ենք քրոնիկական ընթացքով երկար բորբոքային պրոցեսներ, ընդհանուր դիսպլաստիկ փոփոխություններով կամ առանձին նոզոլոգիաներ։ Դրանք հաճախ կամ միշտ առաջացնում են չարորակ նորագոյացություններ։ Գոյություն ունեն նախաքաղցկեղի տեսակներ որոնք առաջանում են բերանի խոռոչում։ Բերանի խոռոչի քաղցկեղների որոշ տեսակներ կարող են սկսվել սպիտակ բծերից(լեյկոպլակիա), կարմիր բծերից(էրիթրոպլակիա) կամ սպիտակակարմրավուն բծերից(էրիթրոլեյկոպլակիա)։ Այլ տեսակների դեպքում կարող է դիտվել բերանի ենթալորձաթաղանթային ֆիբրոզ և ակտինիկ շրթնաբորբ[30]։ Հնդկական մայրցամաքում բերանի ենթալորձաթաղանթային ֆիբրոզը շատ տարածված է՝ արեկա ծամելու պատճառով։ Կլինիկական նշաններից են բերանի սահմանափակ բացումը և կծու կերակուր ուտելիս այրման զգացումը։ Ախտահարումն ունի պրոգրեսիվ ընթացք, որի դեպքում բերանի բացումն աստիճանաբար սահմանափակվում է, իսկ ավելի ուշ փուլում դժվարանում է նորմալ սնվելը։
Հետազոտություն խմբագրել
2022 թվականի օգոստոսի 17-ին հրապարակված հոդվածը ներկայացրել է նանոինժեներական մեխանիզմով ստեղծված տեղային միջլորձաթաղանթային մեխանիզմով ցիսպլատինի տեղափոխումը, որպես բերանի խոռոչի քաղցկեղի բուժման մեթոդ։ PRV111-ը նանոտեխնոլոգիայի վրա հիմնված համակարգ է, որն ապահովվում է ցիսպլատինով բեռնված խիտոզանի մասնիկների ներմուծումը, ինչն առաջացնում է հակաուռուցքային պատասխան տափակ բջջային քաղցկեղի դեմ։ Այն նաև նվազեցնում է ցիսպլատինի թունավոր ազդեցությունը և կանխում է ուռուցքի կրկնությունը in vivo պայմաններում։ Կլինիկական հետազոտությունը ցույց է տվել, որ PRV111-ը պատասխանատու է ուռուցքի ներսում և հարակից ավշային հանգույցներում ցիտոտոքսիկ դեղամիջոցների բարձր կոնցենտրացիայի պահպանման համար։ Հետազոտության տվյալներից ելնելով կարելի է եզրակացնել, որ PRV111-ը ապագայում կարող է օգտագործվել, որպես բերանի խոռոչի քաղցկեղի բուժման մեթոդ[31]։
Ախտաֆիզիալոգիա խմբագրել
Բերանի խոռոչի տափակ բջջային քաղցկեղը առաջանում է էպիթելի փշաձև շերտի բջիջների անկանոն բաժանման արդյունքում։ Մեկ պրեկուրսոր բջիջը վերափոխվում է կլոնի, որը բաղկացած է բազմաթիվ դուստր բջիջներից, որոնք ունեն փոփոխված գեների կուտակումներ՝ օնկոգեններ։ Ի տարբերություն բարորակ ուռուցքների չարորակ ուռուցքները առաջացնում են մետաստազներ։ Մետաստազների առաջացումը պայմանավորված չէ ուռուցքի չափով, մեծությամբ և զարգացման աստիճանով։ Հաճախ թվացյալ դանդաղ աճ ունեցող ուռուցքները կարող են տարածուն մետաստազներ տալ։ Միայն արագ աճը չէ, որ բնութագրում է քաղցկեղը, այլ նրանց ունակությունը արտազատել ֆերմենտներ, անգիոգեն գործոններ, ներխուժման գործոններ, աճի գործոններ և շատ այլ գործոններ, որոնք թույլ են տալիս դրա տարածումը[2]։
Ախտորոշում խմբագրել
Բերանի խոռոչի քաղցկեղի ախտորոշումն անհրաժեշտ է՝ նախնական ախտորոշման, փուլավորման և բուժման պլանավորման համար։ Սկզբում իրականացվում է հիվանդության ամբողջական պատմության հավաքում և անհրաժեշտ կլինիկական հետազոտությունները, այնուհետև կասկածելի ախտահարման շրջանից բիոպսիայի բիջոցով վերցվում է նմուշ հետագա հյուսվածքաբանական հետազոտության համար։ Այս հետազոտությունը կարող է անցկացվել բիոպսիայի հետևյալ մեթոդներով՝ նշտարային(անգ․ scalpel), դակիչ(անգ․ punch), բարակ և հաստ ասեղային։ Միջամտության ժամանակ վիրաբույժը ախտահարված հյուսվածքի նմուշ վերցնելու համար կարող է ամբողջությամբ հեռացնել կամ կտրել ախտահարման մի մասը։ Վերջինս ենթարկվում է մանրադիտակայի հետազոտման ախտաբանի կողմից[32]։ Բերանի խոռոչի քաղցկեղի ախտորոշման համար խոզանակային բիոպսիան ճշգրիտ ախտորոշման մեթոդ չէ[33]։ Թքային բիոմարկերները դեռևս հետազոտման փուլում են, բայց ստացված արդյունքները խոստումնալից են և այս մեթոդը ապագայում կարող է օգտագործվել որպես ոչ ինվազիվ ախտորոշիչ մեթոդ[34]։
Ախտաբանը ստացված նմուշի հետազոտման արդյունքում կտրամադրի հյուսվածքաբանական ախտորոշման (օրինակ՝ թիթեղաբջջային քաղցկեղ) և բջիջների կառուցվածքից ելնելով քաղցկեղի դասակարգման տվյալներ։ Նրանք նաև կարող են տրամադրել լրացուցիչ տեղեկություն, որը կարող է օգտագործվել փուլավորման և բուժման պլանավորման ժամանակ, ինչպիսիք են միտոտիկ արագությունը, ներխուժման խորությունը և հյուսվածքի HPV կարգավիճակը։
Քաղցկեղի հաստատումից հետո անհրաժեշտ այլ թեստերն են՝
- Վնասվածքի չափը ավելի լավ գնահատելու համար՝ ՀՇ, ՄՌՇ կամ ՊԷՇ 18Ֆ-Ֆլյուրոդեօքսիգլյուկոզով (18F-fluorodeoxyglucose) (ՖԴԳ)[32]
- Դեպի վերին շնչուղիներ և մարսողական տրակտ տարածված մետաստազների որոնման համար՝ էնդոսկոպիա
- Դեպի ավշային հանգույցներ տարածված մետաստազների որոնման համար՝ՀՇ
- Մարմին այլ հատվածներ տարածված մետաստազների որոնման համար՝ Կրծքավանդակի ռենտգեն հետազոտությունը, Միջուկային բժշկության հետազոտությունը
Կարող են անցկացվել նաև այլ, ավելի ինվազիվ թեստերը, ինչպիսիք են՝ բարակ ասեղային ասպիրացիան, ավշային հանգույցների բիոպսիան։ Երբ քաղցկեղը տարածվել է ավշային հանգույցների վրա, անհրաժեշտ է որոշել դրանց ճշգրիտ վայրը, չափը և պարկուճից դուրս (ավշային հանգույցների) տարածումը, քանի որ յուրաքանչյուրը կարող է էական ազդեցություն ունենալ բուժման և կանխատեսման վրա։ Լիմֆատիկ հանգույցնր տարածման ձևի անգամ փոքր տարբերությունը կարող է էական ազդեցություն ունենալ բուժման և կանխատեսման վրա։ Քանի որ վերինշնչուղիների և մարսողական տրակտի հյուսվածքները հիմնականում ենթարկվում են նույն քաղցկեղածի ազդեցության և այլ առաջնային քաղցկեղները սովորական երևույթ են կարող է առաջարկվել ամբողջական էնդոսկոպիկ հետազոտություն՝ պանէնդոսկոպիա[35][36]։
Այս հավաքական բացահայտումներից ելնելով և հաշվի առնելով բուժառուի առողջական վիճակն ու ցանկությունները, քաղցկեղի թիմը մշակում է բուժման ծրագիր։ Քանի որ բերանի խոռոչի քաղցկեղների մեծամասնությունը պահանջում է վիրաբուժական միթամտություն, հիստոպաթոլոգիական թեստերի երկրորդ խումբը կկատարվի հեռացված ցանկացած ուռուցքի վրա՝ որոշելու կանխատեսումը, լրացուցիչ վիրահատության, քիմիաթերապիայի, ճառագայթման, իմունոթերապիայի կամ այլ միջամտությունների անհրաժեշտությունը։
Դասակարգում խմբագրել
Բերանի քաղցկեղը գլխի և պարանոցի քաղցկեղների ենթախումբ է, վերջինս ներառում են բերանըմպանի, կոկորդի, քթի խոռոչի և հարքթային սինուսների, թքագեղձերի և վահանաձև գեղձի քաղցկեղները։ Բերանի խոռոչի մելանոման, մինչդեռ գլխի և պարանոցի քաղցկեղի մի մասը դիտարկվում է առանձին[1]։ Բերանի խոռոչում կարող են դիտվել նաև այլ քաղցկեղային ախտահարումներ (օրինակ՝ ոսկորների քաղցկեղ, լիմֆոմա կամ հեռավոր տեղամասերից մետաստատիկ քաղցկեղներ), սակայն դրանք չեն դասվում բերանի խոռոչի քաղցկեղների շարքին[1]։
Փուլավորում խմբագրել
Բերանի խոռոչի քաղցկեղի փուլավորումը քաղցկեղի տարածման աստիճանի գնահատումն է իր սկզբնական աղբյուրից[37]։ Դա բերանի խոռոչի քաղցկեղի և՛ կանխատեսման, և՛ հնարավոր բուժման վրա ազդող կարևոր գործոններից մեկն է[37]։
Բերանի խոռոչի և ըմպանի տափակ բջջային քաղցկեղի գնահատման համար օգտագործում է TNM դասակարգումը (ուռուցք, հանգույց, մետաստազ)։ Սա հիմնված է առաջնային ուռուցքի չափի, ավշային հանգույցների ներգրավվածության և հեռավոր մետաստազների վրա[38]։
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TMN գնահատումը թույլ է տալիս անձին դասակարգել պրոգնոստիկ փուլային խմբի մեջ;[38]
| Երբ T-ն... | և N-ն... | և M-ն... | Ապա փոիլը հետևյալն է... |
|---|---|---|---|
| Tis | N0 | M0 | 0 |
| T1 | N0 | M0 | I |
| T2 | N0 | M0 | II |
| T3 | N0 | M0 | III |
| T1,T2,T3 | N1 | M0 | III |
| T4a | N0,N1 | M0 | IVA |
| T1,T2,T3,T4a | N2 | M0 | IVA |
| Any T | N3 | M0 | IVB |
| T4b | Any N | M0 | IVB |
| Any T | Any N | M1 | IVC |
Սքրինինգ խմբագրել
2013 թվականին ամերիկյան USPSTF-ը հայտարարեց, որ առաջնային բժշկական օղակի ներկայացրած եծահասակների բերանի խոռոչի քաղցկեղի անախտանիշ ձևի սքրինինգի ժամանակ ստացված տվյալների ապացույցները անբավարար օգուտների և վնասների հավասարակշռությունը որոշելու համար[39]։ Ընտանեկան Բժիշկների Ամերիկյան Ակադեմիան եկավ նմանատիպ եզրահանգման, մինչդեռ Քաղցկեղի Ամերիկյան Միությունը խորհուրդ է տալիս, որ 20 տարեկանից բարձր մեծահասակները, ովքեր անցնում են տարեկան բժշկական զննություն պետք է նաև անցնեն բերանի խոռոչը հետազոտություն բերանի խոռոչի քաղցկեղը բացառելու համար[39]։ Ամերիկյան Ստոմատոլոգների Ասոցիացիան խորհուրդ է տալիս, որ բժշկական ծառայություն մատուցողները սովորական հետազոտությունների ժամանակ զգոն լինեն քաղցկեղի նշանների հանդեպ[39]։
Կան մի շարք զննման սարքեր, ինչպիսիք են տոլուիդին կապույտը, խոզանակային բիոպսիան կամ ֆլուորեսցենտային ախտորոշումը։ Այնուամենայնիվ, չկա որևէ ապացույց, որ այդ սարքերի օգտագործումը ընդհանուր ստոմատոլոգիական պրակտիկայում տեղին է կամ օգտակար[40]։ Սքրինինգային սարքերի օգտագործման հնարավոր ռիսկերը ներառում են կեղծ պոզիտիվ պատասխանները, անհարկի վիրաբուժական բիոպսիաները և ֆինանսական ծանրաբեռնվածությունը[40]։ Միկրոնուկլեար լաբորատոր ախտորոշումը կարող է օգնել նախաքաղցկեղային և քաղցկեղային ախտահարումների տարբերակման գործում, դրանով իսկ բարելավել ապրելիության տոկոսը և նվազեցնել բուժման հետ կապված հիվանդացությունը։
Կան նաև հետազոտություններ, որոնք ցույց են տալիս բերանի բջջաբանությունը որպես բերանի խոռոչի քաղցկեղի ախտորոշիչ թեստ օգտագործելու պոտենցիալը, ավանդական բիոպսիայի մեթոդների փոխարեն։ Բերանի բջջաբանության մեջ խոզանակն օգտագործվում է կասկածելի ախտահարումից,տարածքից որոշ բջիջներ վերցնելու համար և դրանք ուղարկվում են լաբորատորիա հետազոտության համար[41]։ Այս մեթոդը կարող է շատ ավելի քիչ ինվազիվ և ցավոտ լինել հիվանդի համար, այնուամենայնիվ, անհրաժեշտ է հետագա հետազոտություններ կատարել, նախքան բերանի խոռոչի բջջաբանությունը կարող է դիտարկվել որպես արդյունավետ սովորական սքրինինգ գործիք ի համեմատ դասական բիոպսիայի[41]։։
Բուժում խմբագրել
Տափակ բջջային քաղցկեղը սովորաբար բուժվում է առանձին վիրաբուժական միջամտությամբ կամ օժանդակ թերապիայի հետ համատեղ,որը ներառում է ճառագայթումը, քիմիաթերապիա կամ առանց քիմիաթերապիայի։ Քիչ ախտահարումների դեպքում (T1), թե վիրաբուժական և թե ճառագայթային միջամտությունները ունեն նմանատիպ վերահսկման աստիճան, ուստի որոշումն այն մասին, թե որն օգտագործել, հիմնված է ֆունկցիոնալ արդյունքների և բարդությունների մակարդակի վրա։
Վիրաբուժություն խմբագրել
Շատ դեպքերում, բերանի խոռոչից և պարանոցից տափակ բջջային քաղցկեղի հեռացումը իրականացվում է վիրահատության միջոցով։ Սա իր հերթին թույլ է տալիս իրականացնել հյուսվածքի մանրակրկիտ զննում հյուսվածքաախտաբանական բնորոշում տալու համար, ինչպիսիք են ախտահարման խորությունը և տարածվածության աստիճանը դեպի ավշային հանգույցներ, որոնք կարող են պահանջել ճառագայթում կամ քիմիաթերապիա։ Փոքր ախտահարումների դեպքում (T1–2) բերանի խոռոչ մուտքն իրականացվում է բերանից։ Երբ ախտահարումն ավելի մեծ է կամ առկա է հասանելիության սահմանափակում, օրինակ՝ սահմանափակ բերանի բացում, վերին կամ ստորին շրթունքի ճեղքված, միջամտությունը կարող է ընդգրկել վերին կամ ստորին ծնոտների ոսկրային հյուսվածքը, դեպի բերան ավելի մեծ մուտք ապահովելու համար։ Երբ ուռուցքն ընդգրկում է ծնոտի ոսկորը, կամ երբ վիրահատական միջամտությունը կամ ճառագայթումը կառաջացնեն բերանի բացման խիստ սահմանափակում, ուռուցքի հետ միասին ոսկորի մի մասը նույնպես հեռացվում է։
Պարանոցի քաղցկեղի վարում խմբագրել
Բերանի խոռոչից քաղցկեղի տարածումը դեպի շրջակա պարանոցային ավշային հանգույցներ ունի հսկայական ազդեցություն ապրելիության տոկոսի վրա։ Բերանի քաղցկեղի ունեցող մարդկանց 60-ից 70%-ի մոտ վաղ փուլերում պարանոցի ավշային հանգույցների կլինիկական ախտահարում չի դիտվի, սակայն այդ մարդկանց 20-30%-ը (կամ բոլոր տուժածների մինչև 20%-ը) կունենա կլինիկորեն աննկատելի քաղցկեղի տարածում։
Պարանոցի քաղցկեղի վերահսկումը շատ կարևոր է, քանի որ դրանով պայմանավորված ապրելիությունը կարող է նվազել 50%-ով[42]։ Աախտորոշման փուլում, եթե կան պարանոցի ավշային հանգույցների ներգրավվածության ապացույցներր, ապա կատարվում է պարանոցի արմատական դիսեկցիա(հատում,հեռացում)։ Երբ պարանոցի ավշահանգույցների կլինիկական ախտահարվածության ապացույց չկա, բայց բերանի խոռոչի քաղցկեղի տարածման բարձր ռիսկ կա (օրինակ՝ T2 կամ ավելի բարձր մակարդակի ախտահարումներ), ապա կարող է իրականացվել թիակակորճային մկանի մակարդակից բարձր ավշային հանգույցների պարանոցային հատվածի դիսեկցիան։ 4 մմ կամ ավելի հաստություն ունեցող T1 ախտահարումները պարանոցի հանգույցներ տարածվելու մեծ վտանգ են ներկայացնում։ Եթե հիվանդությունը քաղցկեղի հեռացումից հետո հայտնաբերվում է հանգույցներում (բայց կլինիկորեն չի դրսևորվում), ռեցիդիվը կկազմի 10-24%։ Եթե հետվիրահատական ճառագայթյին թերապիա իրականացվի, ապա ձախողման մակարդակը կկազմի 0-15%։ Եթե ախտորոշման փուլում քաղցկեղը հայտնաբերվում է ավշային հանգույցներում և վիրահատությունից հետո ավելացվում է ճառագայթային թերապիան, հիվանդության վերահսկման տոկոսը կազմում է 80 և ավելի տոկոս[43]։
Ճառագայթային թերապիա և քիմիաթերապիա խմբագրել
Քիմիաթերապիան և ճառագայթային թերապիան առավել հաճախ օգտագործվում են վիրահատությունից հետո որպես լրացուցիչ միջոց՝ բերանի խոռոչի քաղցկեղը վերահսկելու նպատակով, երբ քաղցկեղը 1-ին փուլից մեծ է և/կամ տարածվել է տարածաշրջանային ավշային հանգույցների կամ մարմնի այլ մասերի վրա։ Շատ փոքր վնասվածքների դեպքում ճառագայթային թերապիան կարող է օգտագործվել առանձին, վիրահատության փոխարեն։ Մեծ ախտահարումների դեպքում,որոնք չեն կարող ամբողջությամբ հեռացվել կամ տարածվել են պարանոցի ավշային հանգույցների վրա ճառագայթային թերապիան սովորաբար օգտագործվում է որպես օժանդակ միջոց։ Քիմիաթերապիան էֆեկտւվ է բերանի խոռոչի քաղցկեղի դեպքում, երբ այն օգտագործվում է բուժման այլ եղանակների հետ համատեղ, օրինակ՝ ճառագայթային թերապիայի։ Այն միայնակ որպես մոնոթերապիա չի օգտագործվում։ Այս մեթոդը կարող է օգտագործվել նաև կյանքը երկարացնելու համար, երբ բուժումը քիչ հավանական է և կարող է համարվել պալիատիվ, բայց ոչ բուժիչ խնամք[44]։
Մոնոկլոնալ հակամարմինային թերապիան (այնպիսի գործոնով ինչպիսին ցետուքսիմաբն է) արդյունավետ է գլխի և պարանոցի տափակբջջային քաղցկեղի բուժման ժամանակ և, ամենայն հավանականությամբ մեծ դեր կունենա հիվանդության հետագա վարման գործընթացում, համակցված այլ հաստատված բուժման հետ։ Մեթոդի կիրառումը այնուամենայնիվ չի փոխարինի գլխի և պարանոցի քաղցկեղի քիմիաթերապիային[44][45]։ Նմանապես, մոլեկուլային նպատակային թերապիաները և իմունոթերապիաները կարող են արդյունավետ լինել բերանի խոռոչի և բերանըմպանային քաղցկեղների բուժման գործում։ Աճի էպիդերրմալ գործոնի ընկալչի հանդեպ մոնոկլոնալ հակամարմին (EGFR mAb) ավելացնելը ստանդարտ բուժմանը կարող է մեծացնել ապրելիության տոկոսը, բացառել քաղցկեղի տարածումը և նվազեցնել քաղցկեղի ետ վերադարձի վտանգը[45]։
Վերականգնում խմբագրել
Բուժումից հետո կարող է անհրաժեշտ լինեն վերականգնողական միջամտություններ միտված բարելավելու շարժումը, ծամելը, կուլ տալը և խոսքը։ Այս փուլում կարող են ներգրավվել խոսքի և լեզվի ախտաբաններ։ Բերանի քաղցկեղի բուժումը սովորաբար իրականացվում է միջդիսցիպլինար թիմի՝ ճառագայթաբաններ, վիրաբույժներ, քիմիոթերապևտներ, սննդագետների, ստոմատոլոգների և նույնիսկ հոգեբանների կողմից։ Մասնագետները ներգրավված են լինում ախտորոշման, բուժման պլանավորման,բուժման և վերականգնման փուլերում։ Բերանի քաղցկեղի տեղակայման պատճառով կարող է լինել մի շրջան, երբ անձը պահանջում է տրախեոտոմիա և կերակրման խողովակ։ Բերանի քաղցկեղի տեղակայումից կախված կարող է գալ մի պահ, երբ անհրաժեշտ է իրականացնել տրախեոտոմիա և կիրառել կերակրման խողովակ։
Կանխատեսում խմբագրել
Ապրելիության տոկոսը կախված է քաղցկեղի հստակ տեղակայման աստիճանից և, թե ինչ փուլում է կատարվել ախտորոշումը։ SEER (անգ․ Surveillance, Epidemiology, and End Results Program) տվյալների բազայի 2011 թվականի տվյալների համաձայն հինգ տարվա ընթացքում ապրելիության տոկոսը կազմել է մոտ 57%։ Հաշվարկների ժամանակ ի նկատի են ունեցել նախնական ախտորոշման բոլոր փուլերը, էթնիկ պատկանելությունները, տարիքային խմբերը, սեռերը և բուժման բոլոր եղանակները։ 1-ին փուլում ախտորոշված քաղցկեղի ապրելիության տոկոսը մոտավորապես 90% է, հետևաբար շեշտը դրվում է վաղ հայտնաբերման վրա՝ մարդկանց ապրելիության տոկոսը բարձրացնելու համար։ Օրինակ՝ նմանատիպ ապրելիության ցուցանիշ է գրանցվել Գերմանիայում[46]։
Վիճակագրություն խմբագրել
2018 թվականին ամբողջ աշխարհում դիտվել է նոր հիվանդացածների 355,000 դեպք, որից 177,000-ը մահվան ելքով[47]։ 355,000-ից մոտ 246,000-ը արական սեռի են, իսկ 108,000-ը՝ իգական[47]։
2013 թվականին բերանի խոռոչի քաղցկեղը հանգեցրել է 135,000 մահվան դեպքերի, իսկ 1990 թվականին դիտվել է գրանցված 84,000 մահացու ելք[48]։ Բերանի խոռոչի քաղցկեղն ավելի հաճախ հանդիպում է ցածր և միջին եկամուտ ունեցող երկրներում[49]։
Եվրոպա խմբագրել
Եվրոպան Հարավարևելյան Ասիայից հետո երկրորդն է բերանի խոռոչի և բերանըմպանային քաղցկեղներին բնորոշ տարիքային չափանիշներով (անգ․՝ Age-standardized Rates, ASR): 2012 թվականին Եվրոպայում գրանցվել է բերանի խոռոչի և շրթունքների քաղցկեղի 61,400 դեպք։ Եվրոպական բոլոր երկրներից Հունգարիան՝ գրանցել է բերանի խոռոչի և ըմպանային քաղցկեղի պատճառով հիվանդացության և մահացության ամենաբարձր թիվը, մինչդեռ Կիպրոսը՝ ամենացածրը[50]
Միացյալ Թագավորություն խմբագրել
2014 թվականին Քաղցկեղի Բրիտանական Հետազոտությունը արձանագրել է 2,386 մահվան դեպք։ Բերանի խոռոչի քաղցկեղի դեպքերի մեծ մասը դիտվել են 50-ից 74 տարեկաների մոտ, այնուամենայնիվ ախտահարումները կարող են հանդիպել նաև երիտասարդների շրջանում[51], բերանի խոռոչի քաղցկեղով հիվանդների 6%-ի տարիքը 45-ից ցածր է[52]։ Եվրոպայում բերանի խոռոչի քաղցկեղով հիվանդացությամ վարկանշային աղյուսակում Մեծ Բրիտանիան տղամարդկանց համար 16-րդն է, իսկ կանանց համար՝ 11-րդը։ Բացի այդ, Մեծ Բրիտանիային հատուկ է տարածաշրջանային փոփոխականություն։ Շոտլանդիան և հյուսիսային Անգլիան ավելի բարձր ցուցանիշներ ունեն, քան հարավային Անգլիան։ Նույն օրինաչափությունը վերաբերում է կյանքի ընթացքում բերանի խոռոչի քաղցկեղի զարգացման ռիսկին, այն է՝ Շոտլանդիայում տղամարդկանց մոտ կազմում է 1,84%, իսկ կանանց մոտ՝ 0,74%, ավելի բարձր, քան Մեծ Բրիտանիայի այլ շրջաններում, համապատասխանաբար 1,06% և 0,48%։
Բերանի խոռոչի քաղցկեղը Մեծ Բրիտանիայում տասնվեցերորդ ամենատարածված քաղցկեղն է (2011 թվականին ՄԹ-ում մոտ 6800 մարդու մոտ բերանի խոռոչի քաղցկեղ է ախտորոշվել), և այն քաղցկեղից մահացության տասնիններորդ ամենատարածված պատճառն է (2012 թվականին այդ հիվանդությունից մահացել է մոտ 2100 մարդ[52]։
Հյուսիսային Եվրոպա խմբագրել
Բերանի խոռոչի և ըմպանի քաղցկեղի ամենաբարձր հաճախականությունը գրանցվել է Դանիայում՝ 100,000-ից 13.0-ի մոտ է դիտվում, որին հաջորդում են Լիտվան (9.9) և Միացյալ Թագավորությունը (9.8)[50]։ Լիտվայում ավելի հաճախ հանդիպւմ է տղամարդկանց մոտ,իսկ Դանիայու՝ կանանց շրջանում։ 2012 թվականին մահացության ամենաբարձր ցուցանիշները գրանցվել են Լիտվայում (7.5), Էստոնիայում (6.0) և Լատվիայում (5.4).[50]։ 1960-ից 1994 թվականներն ընկած ժամանակահատվածում՝ Սկանդինավիայում բերանի խոռոչի քաղցկեղի դեպքերը երիտասարդների մոտ (20-39 տարեկան) աճել է մոտ 6 անգամ[53]։ Դանիայում ի տարբերություն սկանդինավյան այլ երկրների բերանի խոռոչի և ըմպանի քաղցկեղի բարձր հաճախականությունը կարող է պայմանավորված լինել մեծ քանակությամբ ալկոհոլի ընդունմամբ ինչպես նաև մրգերի և բանջարեղենի քիչ օգտագործմամբ։
Արևելյան Եվրոպա խմբագրել
Հունգարիայում (23,3), Սլովակիայում (16,4) և Ռումինիայում (15,5) արձանագրվել են բերանի խոռոչի և ըմպանի քաղցկեղի ամենաբարձր ցուցանիշները[50]։ Ամենաբարձր հիվանդացությունը երկու սեռերի մոտ դիտվել է Հունգարիայում, ինչպես նաև Եվրոպայում մահացության ամենաբարձր մակարդակը[50]։ Քաղցկեղից մահացության մակարդակով Հունգարիան աշխարհում երրորդ տեղն է զբաղեցնում[54]։ Հունգարիայում հիվանդացության և մահացության բարձր մակարդակի հիմնական պատճառներ համարվում են ծխելը, ալկոհոլի չափից ավելի օգտագործումը, քաղցկեղով հիվանդ մարդկանց խնամքի անհավասարությունը և սեռային առանձնահատկություններով պայմանավորված ռիսկի գործոնները[55][56][57][58]։
Արևմտյան Եվրոպա խմբագրել
Արևմտյան Եվրոպայում բերանի խոռոչի քաղցկեղով հիվանդացության մակարդակը ամենաբարձրն է Ֆրանսիայում, Գերմանիայում և Բելգիայում։ ASR ցուցանիշներըները (100,000-ի հաշվարկով) համապատասխանաբար 15.0, 14.6 և 14.1 են։ Ըստ սեռային պատկանելության նույն երկրները կրկին զբաղեցնում են առաջին 3 տեղերը տղամարդկանց համար, սակայն այլ կարգով՝ Բելգիա 21.9), Գերմանիա (23.1 և Ֆրանսիա (23.1: Ֆրանսիայի, Բելգիայի և Նիդերլանդների ցուցանիշները ամենաբարձրն են կանանց համար՝ համապատասխանաբար 7.6, 7.0 և 7.0[50]:
Հարավային Եվրոպա խմբագրել
Հարավային Եվրոպայում բերանի խոռոչի և ըմպանի քաղցկեղի արձանագրված դեպքերի ամենաբարձր ցուցանիշներն ունեն Պորտուգալիան, Խորվաթիան և Սերբիան (ASR 100,000-ի համար)։ Այս արժեքներն են համապատասխանաբար 15.4, 12, և 11.7։
Միացյալ Նահանգներ խմբագրել
2022 թվականին մոտ 54,000 ամերիկացիների մոտ կանխատեսվում է, որ կախտորոշվի բերանի խոռոչի կամ ըմպանի քաղցկեղ։ 66% դեպքերում դրանք հայտնաբերվում են հիվանդության ուշ՝ երրորդ և չորրորդ փուլերում։ Ինչը հանգեցնում է ավելի քան 8000 մահվան։ Վաղ ախտորոշման դեպքում,հինգ տարվա կտրվածքով ախտորոշվածների կեսից մի փոքր ավելին ողջ կմնա։ Ապրելիության նման ցուցանիշներ հաղորդում են նաև այլ երկրները։Օրինակ, բերանի խոռոչի քաղցկեղի հնգամյա հարաբերական ապրելիությունը Գերմանիայում կազմում է մոտ 55%[46] ԱՄՆ-ում բերանի խոռոչի քաղցկեղը կազմում է բոլոր չարորակ ուռուցքների մոտ 8 տոկոսը։ Սևամորթ տղամարդկանց մոտ, ի տարբերություն սպիտակամորթ տղամարդկանց բերանի խոռոչի քաղցկեղի ընդհանուր ռիսկն ավելի բարձր։ Իսկ սպիտակամորթ տղամարդկանց մոտ, ի տարբերություն սևամորթ տղամարդկանց բերանի խոռոչի հատուկ քաղցկեղների, օրինակ շրթունքների քաղցկեղի առաջացման վտանգն ավելի բարձր է։ Համաձայն 3 հետազոտությունների արդյունքների բերանի խոռոչի քաղցկեղի առաջացման մակարդակը սեռային պատկանելությամբ պայմանավորված նվազում է[59]։
Բոլոր քաղցկեղներից բերանի խոռոչի քաղցկեղը հանդիպում է տղամարդկանց 3%-ի և կանանց մոտ՝ 2%-ի մոտ։ ԱՄՆ-ում բերանի խոռոչի քաղցկեղի նոր դեպքերը 2013 թվականի դրությամբ մոտ 66000 են, որոնցից գրեթե 14000-ը վերագրվում է լեզվի, իսկ մոտ 12000-ը՝ բերանի խոռոչի, իսկ մնացածը՝ ըմպանի քաղցկեղին։ Նախորդ տարում ախտորոշվել է շուրթերի և բերանի խոռոչի քաղցկեղների 1,6%-ը։ Որտեղ տարիքային ստանդարտացված հիվանդացության չափանիշը (անգ․ ASIR) 100,000 բնակչի հաշվով Ամերիկայի Միացյալ Նահանգների բոլոր շրջաններում գնահատվում է 5,2[60]։ ԱՄՆ-ում հանդիպող քաղցկեղների վիճակագրական սանդղակում բերանի խոռոչի քաղցկեղը տասնմեկերորդն է տղամարդկանց շրջանում, մինչդեռ Կանադայում և Մեքսիկայում այն համապատասխանաբար տասներկուերորդն ու տասներեքերորդն է։ Կանադայում և Մեքսիկայում տղամարդկանց շուրթերի և բերանի խոռոչի քաղցկեղի ASIR-ը համապատասխանաբար 4,2 և 3,1 է[60]։
Հարավային Ամերիկա խմբագրել
2012 թվականի դրությամբ ASIR ցուցանիշը Հարավային Ամերիկայի բոլոր աշխարհագրական տարածաշրջաններում կազմում է 3.8։ Շուրթերի և բերանի խոռոչի քաղցկեղի պատճառով դիտվել է շուրջ 6,046 մահվան դեպք, տարիքային ստանդարտացված մահացության ցուցանիշը 1.4 է[61]։
Բրազիլիայում 7-րդ ամենատարածված քաղցկեղը շրթունքների և բերանի խոռոչի քաղցկեղն է։ 2012 թվականի մոտ 6930 նոր դեպք է ախտորոշվել։ Այս թիվը աճում է և ունի ընդհանուր բարձր ASIR՝ 7,2 100,000 բնակչի հաշվով, ինչի հետևանքով գրանցվել է մոտ 3000 մահվան դեպք[61]։
Ցուցանիշներն աճում են, թե՛ տղամարդկանց և թե՛ կանանց մոտ։ 2017 թվականի դրությամբ կախտորոշվի բերանային խոռոչի քաղցկեղի գրեթե 50000 նոր դեպք, ընդ որում հիվանդացության մակարդակը տղամարդկանց մոտ սպասվում է,որ ավելի քան երկու անգամ բարձր կլինի, քան կանանց մոտ[61]։
Ասիա խմբագրել
Բերանի խոռոչի քաղցկեղը Ասիայում քաղցկեղի ամենատարածված տեսակներից մեկն է, քանի որ այն կապված է ծխելու (ծխախոտ, բիդի), բեթլի և ալկոհոլի օգտագործման հետ։ Տարածաշրջանում հիվանդացության ամենաբարձր ցուցանիշներ դիտվում են Հարավային Ասիայում, մասնավորապես՝ Հնդկաստանում, Բանգլադեշում, Շրի Լանկայում, Պակիստանում և Աֆղանստանում[62]։ Հարավարևելյան Ասիայում և արաբական երկրներում տարածվածությունն այնքան էլ բարձր չէ։ Բերանի խոռոչի քաղցկեղի գրանցված դեպքերի ցուցանիշը համապատասխանաբար 1,6-ից 8,6/100000 և 1,8-ից 2,13/100,000-ի միջակայքում է[63][64]։ Համաձայն GLOBOCAN-ի 2012 թվականիի տվյալների, քաղցկեղով հիվանդացության և մահացության տարիքային ստանդարտացված ցուցանիշներն ավելի բարձր էին տղամարդկանց, քան կանանց մոտ։ Այնուամենայնիվ, որոշ տարածքներում, մասնավորապես Հարավարևելյան Ասիայում երկու սեռերի համար էլ ցուցանիշները նույնն էին[63]։ Բերանի խոռոչի տափակ բջջային քաղցկեղ ախտորոշվածների միջին տարիքը մոտավորապես 51-ից 55 է[62] 2012 թվականին բերանի խոռոչի քաղցկեղի[65]։
Հնդկաստան խմբագրել
Հնդկաստանում բերանի խոռոչի քաղցկեղը քաղցկեղի երրորդ ամենատարածված ձևն է։ 2012 թվականին ախտորոշվել են ավելի քան 77 000 նոր դեպքեր (տղամարդկանց և կանանց հետևյալ հարաբերակցությամբ՝ 2,3:1)[66]։ Ըստ հետազոտությունների ժամում գրանցվում է ավելի քան հինգ մահ[67]։ Նման բարձր հաճախականության պատճառներից մեկը կարող է լինել բեթլի և արեկայի ծամելու տարածվածությունը, որոնք համարվում են բերանի խոռոչի քաղցկեղի զարգացման ռիսկի գործոններ[68]։
Աֆրիկա խմբագրել
Աֆրիկայում բերանի խոռոչի քաղցկեղի տարածվածության վերաբերյալ տվյալները սահմանափակ են։ Ստորև ներկայացված ցուցանիշները նկարագրում են տարեկան 100 000 անձի հաշվով նոր դեպքերի կամ մահերի թիվը[65]։
Բերանի խոռոչի քաղցկեղի գործակիցը 2,6 է երկու սեռերի համար։ Այս ցուցանիշն ավելի բարձր է տղամարդկանց մոտ՝ 3,3 և ավելի ցածր՝ կանանց մոտ՝ 2,0[65]։
Մահացության գործակիցը երկու սեռերի դեպքում ավելի ցածր է, քան հիվանդացության մակարդակը` 1,6։ Այս ցուցանիշը կրկին բարձր է տղամարդկանց մոտ՝ 2.1, իսկ կանանց մոտ՝ 1.3[65]։
Ավստրալիա խմբագրել
Տարեկան 100 000 անձի հաշվով դիտվող նոր դեպքերի կամ մահերի ցուցանիշները հետևյալն են՝ բերանի խոռոչի քաղցկեղի հաճախականությունը միջինում 6,3 է երկու սեռերի համար, տղամարդկանց մոտ ավելի բարձր է՝ 6,8–8,8, իսկ կանանց մոտ՝ 3,7–3,9[69]։ Երկու սեռերի համար մահացության ցուցանիշը զգալիորեն ցածր է (1.0)ի համեմատ հիվանդացության ցուցանիշի։ Այս ցուցանիշն ավելի բարձր է տղամարդկանց մոտ՝ 1,4 և ավելի ցածր՝ կանանց մոտ՝ 0,6[70]:Աղյուսակ 1-ը ներկայացնում է բերանի խոռոչի քաղցկեղի տարիքային ստանդարտացված հիվանդացության և մահացության ցուցանիշները՝ ելնելով բերանի խոռոչում տեղակայումից։ «Այլ բերան» ասելով նկատի են ունենում քաղցկեղի ոչ տիպիկ տեղակայումը՝ այտի լորձաթաղանթին, գավիթին և բերանի այլ չսպեցիֆիկացված մասերին։ Տվյալների համաձայն շուրթերի քաղցկեղը հիվանդացության ամենաբարձր մակարդակն ունի, մինչդեռ լնդերի քաղցկեղն ընդհանուր առմամբ ամենացածրն է։ Մահացության մակարդակով տղամարդկանց մոտ ամենաբարձր ցուցանիշն ունի բերանի խոռոչի քաղցկեղը, իսկ կանանց մոտ՝ լեզվի քաղցկեղը։ Ընդհանուր առմամբ շուրթերի, քիմքի և լնդերի քաղցկեղն ունեն մահացության ամենացածր մակարդակը[70]։
| Տեղակայում | Տարեկան 100 000 անձի հաշվով դիտվող նոր դեպքեր | Տարեկան 100 000 անձի հաշվով դիտվող մահացության դեպքեր | ||||
|---|---|---|---|---|---|---|
| Երկու սեռեր | Արական սեռ | Իգական սեռ | Երկու սեռեր | Արական սեռ | Իգական սեռ | |
| Շուրթ | 5.3 | 8.4 | 2.4 | 0.1 | 0.1 | 0.0 |
| Լեզու | 2.4 | 3.3 | 1.4 | 0.7 | 1.1 | 0.4 |
| Լնդեր | 0.3 | 0.4 | 0.3 | 0.1 | 0.1 | 0.0 |
| Բերանի հատակ | 0.9 | 1.4 | 0.5 | 0.2 | 0.3 | 0.1 |
| Քիմք | 0.6 | 0.7 | 0.4 | 0.1 | 0.2 | 0.1 |
| Այլ բերան | 0.7 | 0.8 | 0.6 | 0.2 | 0.2 | 0.1 |
| Հիմնական թքագեղձեր | 1.2 | 1.6 | 0.9 | 0.3 | 0.4 | 0.2 |
| Բերանըմպան | 1.9 | 3.0 | 0.8 | 0.7 | 1.2 | 0.3 |
Այլ կենդանիներ խմբագրել
Բերանի խոռոչի քաղցկեղը չորրորդ ամենատարածված տեսակն է անասնաբուժության մեջ[71]:։
Ծանոթագրություններ խմբագրել
- ↑ 1,0 1,1 1,2 1,3 Edge SB, և այլք: (American Joint Committee on Cancer) (2010). AJCC cancer staging manual (7th ed.). New York: Springer. ISBN 9780387884400. OCLC 316431417.
- ↑ 2,0 2,1 2,2 2,3 Marx RE, Stern D (2003). Oral and maxillofacial pathology : a rationale for diagnosis and treatment. Stern, Diane. Chicago: Quintessence Pub. Co. ISBN 978-0867153903. OCLC 49566229.
- ↑ «Head and Neck Cancers». CDC. 2019 թ․ հունվարի 17. Վերցված է 2019 թ․ մարտի 10-ին.
- ↑ 4,0 4,1 Gandini S, Botteri E, Iodice S, Boniol M, Lowenfels AB, Maisonneuve P, Boyle P (2008 թ․ հունվար). «Tobacco smoking and cancer: a meta-analysis». International Journal of Cancer. 122 (1): 155–64. doi:10.1002/ijc.23033. PMID 17893872. S2CID 27018547.
- ↑ Goldstein BY, Chang SC, Hashibe M, La Vecchia C, Zhang ZF (2010 թ․ նոյեմբեր). «Alcohol consumption and cancers of the oral cavity and pharynx from 1988 to 2009: an update». European Journal of Cancer Prevention. 19 (6): 431–65. doi:10.1097/CEJ.0b013e32833d936d. PMC 2954597. PMID 20679896.
- ↑ «The Tobacco Connection». The Oral Cancer Foundation. Վերցված է 2019 թ․ մարտի 10-ին.
- ↑ Kreimer AR, Clifford GM, Boyle P, Franceschi S (2005 թ․ փետրվար). «Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review». Cancer Epidemiology, Biomarkers & Prevention. 14 (2): 467–75. doi:10.1158/1055-9965.EPI-04-0551. PMID 15734974.
- ↑ Goldenberg D, Lee J, Koch WM, Kim MM, Trink B, Sidransky D, Moon CS (2004 թ․ դեկտեմբեր). «Habitual risk factors for head and neck cancer». Otolaryngology–Head and Neck Surgery. 131 (6): 986–93. doi:10.1016/j.otohns.2004.02.035. PMID 15577802. S2CID 34356067.
- ↑ Kerawala C, Roques T, Jeannon JP, Bisase B (2016 թ․ մայիս). «Oral cavity and lip cancer: United Kingdom National Multidisciplinary Guidelines». The Journal of Laryngology and Otology. 130 (S2): S83–S89. doi:10.1017/S0022215116000499. PMC 4873943. PMID 27841120.
- ↑ «Cancer today». gco.iarc.fr (անգլերեն). Վերցված է 2019 թ․ հունիսի 9-ին.
- ↑ «USCS Data Visualizations». gis.cdc.gov. Արխիվացված է օրիգինալից 2019 թ․ հունվարի 25-ին. Վերցված է 2019 թ․ մարտի 10-ին.
- ↑ 12,0 12,1 «Cancer Stat Facts: Oral Cavity and Pharynx Cancer». NCI. Վերցված է 2019 թ․ հունիսի 27-ին.
- ↑ «Survival Rates for Oral Cavity and Oropharyngeal Cancer». www.cancer.org. Վերցված է 2019 թ․ մարտի 10-ին.
- ↑ Ravikiran Ongole, Praveen B N, ed. (2014). Textbook of Oral Medicine, Oral Diagnosis and Oral Radiology. Elsevier India. էջ 387. ISBN 978-8131230916.
- ↑ «The Oral Cancer Foundation». Վերցված է 2022 թ․ մարտի 22-ին.
- ↑ «Symptoms of oral cancer—Canadian Cancer Society». www.cancer.ca. Վերցված է 2019 թ․ մարտի 10-ին.
- ↑ 17,0 17,1 Markopoulos AK (2012 թ․ օգոստոսի 10). «Current aspects on oral squamous cell carcinoma». The Open Dentistry Journal. 6 (1): 126–30. doi:10.2174/1874210601206010126. PMC 3428647. PMID 22930665.
- ↑ 18,0 18,1 18,2 18,3 IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (2012). «Personal habits and indoor combustions. Volume 100 E. A review of human carcinogens». IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 100 (Pt E): 1–538. PMC 4781577. PMID 23193840.
- ↑ Cancer Care Ontario (2014). «Cancer Risk Factors in Ontario: Tobacco» (PDF). www.cancercare.on.ca.
- ↑ Mashberg A, Barsa P, Grossman ML (1985 թ․ մայիս). «A study of the relationship between mouthwash use and oral and pharyngeal cancer». Journal of the American Dental Association. 110 (5): 731–4. doi:10.14219/jada.archive.1985.0422. PMID 3859544.
- ↑ Elmore JG, Horwitz RI (1995 թ․ սեպտեմբեր). «Oral cancer and mouthwash use: evaluation of the epidemiologic evidence». Otolaryngology–Head and Neck Surgery. 113 (3): 253–61. doi:10.1016/S0194-5998(95)70114-1. PMID 7675486. S2CID 20725009.
- ↑ Cole P, Rodu B, Mathisen A (2003 թ․ օգոստոս). «Alcohol-containing mouthwash and oropharyngeal cancer: a review of the epidemiology». Journal of the American Dental Association. 134 (8): 1079–87. doi:10.14219/jada.archive.2003.0322. PMID 12956348.
- ↑ Science brief on alcohol-containing mouthrinses and oral cancer, Արխիվացված Մարտ 19, 2012 Wayback Machine American Dental Association, March 2009
- ↑ Warnakulasuriya S, Parkkila S, Nagao T, Preedy VR, Pasanen M, Koivisto H, Niemelä O (2008 թ․ մարտ). «Demonstration of ethanol-induced protein adducts in oral leukoplakia (pre-cancer) and cancer». Journal of Oral Pathology & Medicine. 37 (3): 157–65. doi:10.1111/j.1600-0714.2007.00605.x. PMID 18251940.
- ↑ Alcohol and oral cancer research breakthrough Արխիվացված Մայիս 2, 2009 Wayback Machine
- ↑ Gillison ML, Chaturvedi AK, Anderson WF, Fakhry C (2015 թ․ հոկտեմբեր). «Epidemiology of Human Papillomavirus-Positive Head and Neck Squamous Cell Carcinoma». Journal of Clinical Oncology. 33 (29): 3235–42. doi:10.1200/JCO.2015.61.6995. PMC 4979086. PMID 26351338.
- ↑ Martín-Hernán F, Sánchez-Hernández JG, Cano J, Campo J, del Romero J (2013 թ․ մայիս). «Oral cancer, HPV infection and evidence of sexual transmission». Medicina Oral, Patologia Oral y Cirugia Bucal. 18 (3): e439-44. doi:10.4317/medoral.18419. PMC 3668870. PMID 23524417.
- ↑ «HPV-Positive Tumor Status Indicates Better Survival in Patients with Oropharyngeal Cancer—MD Anderson Cancer Center». www.mdanderson.org.
- ↑ 29,0 29,1 Elad S, Zadik Y, Zeevi I, Miyazaki A, de Figueiredo MA, Or R (2010 թ․ դեկտեմբեր). «Oral cancer in patients after hematopoietic stem-cell transplantation: long-term follow-up suggests an increased risk for recurrence». Transplantation. 90 (11): 1243–4. doi:10.1097/TP.0b013e3181f9caaa. PMID 21119507.
- ↑ Neville BW, Damm DD, Allen CM, Bouquot JE (2002). Oral & maxillofacial pathology (2nd ed.). Philadelphia: W.B. Saunders. էջեր 337, 345, 349, 353. ISBN 978-0721690032.
- ↑ Goldberg, Manijeh; Manzi, Aaron; Conway, Peter; Cantin, Stefanie; Mishra, Vasudha; Singh, Alka; Pearson, Alexander T.; Goldberg, Eric R.; Goldberger, Sam; Flaum, Benjamin; Hasina, Rifat; London, Nyall R.; Gallia, Gary L.; Bettegowda, Chetan; O’Neill, Sonya E. (2022 թ․ օգոստոսի 17). «A nanoengineered topical transmucosal cisplatin delivery system induces anti-tumor response in animal models and patients with oral cancer». Nature Communications (անգլերեն). 13 (1): 4829. Bibcode:2022NatCo..13.4829G. doi:10.1038/s41467-022-31859-3. ISSN 2041-1723. PMC 9385702. PMID 35977936.
- ↑ 32,0 32,1 Gullane P (2016). Sataloff's Comprehensive Textbook of Otolaryngology: Head and Neck Surgery: Head and Neck Surgery. Vol. 5. New Delhi, India: The Health Sciences Publisher. էջ 600. ISBN 978-93-5152-458-8.
- ↑ H Alsarraf A, Kujan O, Farah CS (2018 թ․ փետրվար). «The utility of oral brush cytology in the early detection of oral cancer and oral potentially malignant disorders: A systematic review». Journal of Oral Pathology & Medicine. 47 (2): 104–116. doi:10.1111/jop.12660. PMID 29130527. S2CID 46832488.
- ↑ AlAli, A. M.; Walsh, T.; Maranzano, M. (2020 թ․ օգոստոսի 1). «CYFRA 21-1 and MMP-9 as salivary biomarkers for the detection of oral squamous cell carcinoma: a systematic review of diagnostic test accuracy». International Journal of Oral and Maxillofacial Surgery (English). 49 (8): 973–983. doi:10.1016/j.ijom.2020.01.020. ISSN 0901-5027. PMID 32035907. S2CID 211070749.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link) - ↑ Levine B, Nielsen EW (1992 թ․ օգոստոս). «The justifications and controversies of panendoscopy--a review». Ear, Nose, & Throat Journal. 71 (8): 335–40, 343. doi:10.1177/014556139207100802. PMID 1396181. S2CID 25921527.
- ↑ Clayburgh DR, Brickman D (2017 թ․ հունվար). «Is esophagoscopy necessary during panendoscopy?». The Laryngoscope. 127 (1): 2–3. doi:10.1002/lary.25532. PMID 27774605. S2CID 19124543.
- ↑ 37,0 37,1 Connolly JL, Goldsmith JD, Wang HH, և այլք: (2010). «37: Principles of Cancer Pathology». Holland-Frei Cancer Medicine (8th ed.). People's Medical Publishing House. ISBN 978-1-60795-014-1.
- ↑ 38,0 38,1 38,2 38,3 «AJCC Cancer Staging Form Supplement. AJCC Cancer Staging Manual, eighth Edition Update 05 June 2018» (PDF). www.cancerstaging.org. 2018 թ․ հունիսի 5. Վերցված է 2019 թ․ ապրիլի 7-ին.
- ↑ 39,0 39,1 39,2 «Final Recommendation Statement: Oral Cancer: Screening—US Preventive Services Task Force». www.uspreventiveservicestaskforce.org. 2013 թ․ նոյեմբեր. Վերցված է 2017 թ․ նոյեմբերի 23-ին.
- ↑ 40,0 40,1 Brocklehurst P, Kujan O, O'Malley LA, Ogden G, Shepherd S, Glenny AM (2013 թ․ նոյեմբեր). «Screening programmes for the early detection and prevention of oral cancer». The Cochrane Database of Systematic Reviews. 2021 (11): CD004150. doi:10.1002/14651858.CD004150.pub4. PMC 8078625. PMID 24254989.
- ↑ 41,0 41,1 Walsh T, Macey R, Kerr AR, Lingen MW, Ogden GR, Warnakulasuriya S (2021 թ․ հուլիս). «Diagnostic tests for oral cancer and potentially malignant disorders in patients presenting with clinically evident lesions». The Cochrane Database of Systematic Reviews. 7 (7): CD010276. doi:10.1002/14651858.CD010276.pub3. PMC 8407012. PMID 34282854.
- ↑ Robbins KT, Ferlito A, Shah JP, Hamoir M, Takes RP, Strojan P, և այլք: (2013 թ․ մարտ). «The evolving role of selective neck dissection for head and neck squamous cell carcinoma». European Archives of Oto-Rhino-Laryngology. 270 (4): 1195–202. doi:10.1007/s00405-012-2153-x. PMID 22903756. S2CID 22423135.
- ↑ Zelefsky MJ, Harrison LB, Fass DE, Armstrong JG, Shah JP, Strong EW (1993 թ․ հունվար). «Postoperative radiation therapy for squamous cell carcinomas of the oral cavity and oropharynx: impact of therapy on patients with positive surgical margins». International Journal of Radiation Oncology, Biology, Physics. 25 (1): 17–21. doi:10.1016/0360-3016(93)90139-m. PMID 8416876.
- ↑ 44,0 44,1 Petrelli F, Coinu A, Riboldi V, Borgonovo K, Ghilardi M, Cabiddu M, և այլք: (2014 թ․ նոյեմբեր). «Concomitant platinum-based chemotherapy or cetuximab with radiotherapy for locally advanced head and neck cancer: a systematic review and meta-analysis of published studies». Oral Oncology. 50 (11): 1041–8. doi:10.1016/j.oraloncology.2014.08.005. PMID 25176576.
- ↑ 45,0 45,1 Chan KK, Glenny AM, Weldon JC, Furness S, Worthington HV, Wakeford H (2015 թ․ դեկտեմբեր). «Interventions for the treatment of oral and oropharyngeal cancers: targeted therapy and immunotherapy». The Cochrane Database of Systematic Reviews. 2015 (12): CD010341. doi:10.1002/14651858.CD010341.pub2. PMC 9465394. PMID 26625332.
- ↑ 46,0 46,1 Listl S, Jansen L, Stenzinger A, Freier K, Emrich K, Holleczek B, և այլք: (GEKID Cancer Survival Working Group) (2013). Scheurer M (ed.). «Survival of patients with oral cavity cancer in Germany». PLOS ONE. 8 (1): e53415. Bibcode:2013PLoSO...853415L. doi:10.1371/journal.pone.0053415. PMC 3548847. PMID 23349710.
- ↑ 47,0 47,1 «Cancer today». gco.iarc.fr (անգլերեն). Վերցված է 2019 թ․ հունիսի 9-ին.
- ↑ Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, և այլք: (GBD 2013 Mortality Causes of Death Collaborators) (2015 թ․ հունվար). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013». Lancet. 385 (9963): 117–71. doi:10.1016/S0140-6736(14)61682-2. PMC 4340604. PMID 25530442.
- ↑ Sacker A, Bartley M (2015). Social inequalities in oral health: from evidence to action (PDF). էջ 9. ISBN 9780952737766.
- ↑ 50,0 50,1 50,2 50,3 50,4 50,5 «Cancer of lip, oral cavity and pharynx. [online]». EUCAN. Արխիվացված է օրիգինալից 2017 թ․ դեկտեմբերի 23-ին. Վերցված է 2017 թ․ նոյեմբերի 14-ին.
- ↑ «Mouth cancer». www.nhsinform.scot (անգլերեն). Վերցված է 2021 թ․ ապրիլի 23-ին.
- ↑ 52,0 52,1 «oral cancer statistics». CancerresearchUK. Վերցված է 2014 թ․ հոկտեմբերի 28-ին.
- ↑ Annertz K, Anderson H, Biörklund A, Möller T, Kantola S, Mork J, և այլք: (2002 թ․ սեպտեմբեր). «Incidence and survival of squamous cell carcinoma of the tongue in Scandinavia, with special reference to young adults». International Journal of Cancer. 101 (1): 95–99. doi:10.1002/ijc.10577. PMID 12209594. S2CID 23069745.
- ↑ «World Life Expectancy». 2014.
- ↑ Diz P, Meleti M, Diniz-Freitas M, Vescovi P, Warnakulasuriya S, Johnson N, Kerr A (2017). «Oral and pharyngeal cancer in Europe». Translational Research in Oral Oncology. 2: 2057178X1770151. doi:10.1177/2057178X17701517.
- ↑ Nemes JA, Redl P, Boda R, Kiss C, Márton IJ (2008 թ․ մարտ). «Oral cancer report from Northeastern Hungary». Pathology & Oncology Research. 14 (1): 85–92. doi:10.1007/s12253-008-9021-4. PMID 18351444. S2CID 1187249.
- ↑ Suba Z, Mihályi S, Takács D, Gyulai-Gaál S (2009). «Oral cancer: Morbus hungaricus in the 21st century». Fogorv Sz. 102 (2): 63–68. PMID 19514245.
- ↑ Endre A (2006 թ․ փետրվար). «Hungarian national cancer control programme» (PDF).
- ↑ Moore SR, Johnson NW, Pierce AM, Wilson DF (2000 թ․ մարտ). «The epidemiology of mouth cancer: a review of global incidence». Oral Diseases. 6 (2): 65–74. doi:10.1111/j.1601-0825.2000.tb00104.x. PMID 10702782.
- ↑ 60,0 60,1 Gupta N, Gupta R, Acharya AK, Patthi B, Goud V, Reddy S, և այլք: (2016 թ․ դեկտեմբեր). «Changing Trends in oral cancer - a global scenario». Nepal Journal of Epidemiology. 6 (4): 613–619. doi:10.3126/nje.v6i4.17255. PMC 5506386. PMID 28804673.
- ↑ 61,0 61,1 61,2 «Cancer Facts & Figures 2017». America cancer society.
- ↑ 62,0 62,1 Krishna Rao SV, Mejia G, Roberts-Thomson K, Logan R (2013 թ․ հոկտեմբերի 30). «Epidemiology of oral cancer in Asia in the past decade--an update (2000-2012)». Asian Pacific Journal of Cancer Prevention. Asian Pacific Organization for Cancer Prevention. 14 (10): 5567–5577. doi:10.7314/apjcp.2013.14.10.5567. PMID 24289546.
- ↑ 63,0 63,1 Cheong SC, Vatanasapt P, Yi-Hsin Y, Zain RB, Kerr AR, Johnson NW (2017). «Oral cancer in South East Asia». Translational Research in Oral Oncology. 2: 2057178X1770292. doi:10.1177/2057178X17702921. ISSN 2057-178X.
- ↑ Al-Jaber A, Al-Nasser L, El-Metwally A (2016 թ․ մարտ). «Epidemiology of oral cancer in Arab countries». Saudi Medical Journal. 37 (3): 249–255. doi:10.15537/smj.2016.3.11388. PMC 4800887. PMID 26905345.
- ↑ 65,0 65,1 65,2 65,3 «All Cancers (excluding non-melanoma skin cancer) Estimated Incidence, Mortality and Prevalence Worldwide in 2012». International Agency for Research on Cancer. 2012.
- ↑ Mallath MK, Taylor DG, Badwe RA, Rath GK, Shanta V, Pramesh CS, և այլք: (2014 թ․ մայիս). «The growing burden of cancer in India: epidemiology and social context». The Lancet. Oncology. 15 (6): e205-12. doi:10.1016/s1470-2045(14)70115-9. PMID 24731885.
- ↑ Varshitha A (2015). «Prevalence of Oral Cancer in India». Journal of Pharmaceutical Sciences and Research. 7 (10): e845-48.
- ↑ Chapman DH, Garsa A (2018). «Cancer of the Lip and Oral Cavity». In Hansen E, Roach III M (eds.). Handbook of Evidence-Based Radiation Oncology. Springer International Publishing. էջեր 193–207. doi:10.1007/978-3-319-62642-0_8. ISBN 9783319626413.
- ↑ Chaturvedi AK, Anderson WF, Lortet-Tieulent J, Curado MP, Ferlay J, Franceschi S, և այլք: (2013 թ․ դեկտեմբեր). «Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers». Journal of Clinical Oncology. 31 (36): 4550–9. doi:10.1200/jco.2013.50.3870. PMC 3865341. PMID 24248688.
- ↑ 70,0 70,1 70,2 Farah CS, Simanovic B, Dost F (2014 թ․ սեպտեմբեր). «Oral cancer in Australia 1982-2008: a growing need for opportunistic screening and prevention». Australian Dental Journal. 59 (3): 349–59. doi:10.1111/adj.12198. PMID 24889757.
- ↑ Foale RD, Demetriou J (2010). Saunders Solutions in Veterinary Practice: Small Animal Oncology E-Book (անգլերեն). Elsevier Health Sciences. էջ 49. ISBN 978-0-7020-4989-7.