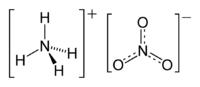
Ամոնիումի նիտրատ
Ամոնիումի նիտրատ (ամոնիումային սելիտրա), քիմիական բանաձևն է NH4NO3, ազոտական թթվի աղերից է[5]։ Առաջին անգամ ստացել են Գլաուբերում, 1659 թվականին[6]։
| Ամոնիումի նիտրատ | |
|---|---|
 | |
 | |
 | |
| Քիմիական բանաձև | H₄N₂O₃, NH₄NO₃ |
| Ֆիզիկական հատկություններ | |
| Մոլային զանգված | 1,3E−25 կիլոգրամ[1] գ/մոլ |
| Խտություն | 1,725 (4-րդ մոդիֆիկացիա) գ/սմ³ |
| Հալման ջերմաստիճան | 169,6 °C[2] և 169,7 °C[3] °C |
| Կազմալուծման ջերմաստիճան | 230 ± 30 °C[3] |
| Գոյացան էնթալպիա | −365,6 կՋ/մոլ[4] կՋ/մոլ |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 20 °C -190 գ/100 մլ |
| Դասակարգում | |
| CAS համար | 6484-52-2 |
| PubChem | 22985 |
| EINECS համար | 229-347-8 |
| SMILES | [NH4+].[N+](=O)([O-])[O-] |
| ЕС | 229-347-8 |
| RTECS | BR9050000 |
| ChEBI | 21511 |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |

Ֆիզիկական հատկություններ խմբագրել
Սպիտակ բյուրեղային նյութ է[7]։ Հալվում է 169,6 °C ջերմաստիճանում, այս ջերմաստիճանից ավելի բարձր տաքացնելիս, սկսվում է նյութի անընդհատ քայքայում, իսկ 210 °C ջերմաստիճանում ընդհանում է ամբողջական քայքայում[8] ։ Եռման ջերմաստիճանը 235 °C է։ Մոլեկուլային զանգվածը 80,04 զ.ա.մ. է[9][10]։
Լուծելիություն խմբագրել
Լուծելիությունը ջրում.
| Ջերմաստիճան, °C | Լուծելիություն, գ/100 մլ |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
Լուծվելիս նկատվում է ջերմության մեծ կլանում, ինչը զգալիորեն դանդաղեցնում է լուծման ընթացքը[11][12]։ Այդ իսկ պատճառով, հագեցած լուծույթ պատրաստելու համար օգտագործում են մեծ քանակի ջերմություն[13][14]։ Ամոնիումի նիտրատը նաև լուծվում է ամոնիակում, պիրիդինում, մեթանոլում և էթանոլում։
Բաղադրություն խմբագրել
Տարրերի պարունակությունը և զանգվածային բաժինները ամոնիումի նիտրատում[15].
- O - 60 %,
- N - 35 %,
- H - 5 %:
Ստացումը խմբագրել
Հիմնական մեթոդ խմբագրել
Ամոնիումի նիտրատ հիմնականում ստանում են ազոտական թթվի և անջուր ամոնիակի փոխազդեցությունից[16]։
Ռեակցիան ընթանում է շատ բուռն կերպով, ջերմության կլանմամբ[17]։ Ամոնիումի նիտրատը քիմիայում օգտագործելիս հիմնականում ջրազրկում է, քանի որ այն շատ հիգրոսկոպիկ նյութ է և նրա մեջ ջրի տոկոսային պարունակությունը որոշելը գործնականում անհնար է[18]։
Հաբերի մեթոդ խմբագրել
Հաբերի մեթոդով ջրածնից և ազոտից ստանում ենք ամոնիակ, որի մի մասը օքսիդանում է մինչև ազոտական թթու, որը փոխազդում է մնացած ամոնիակի հետ, որի արդյունքում ստանում ենք ամոնիումի նիտրատ[19]։
- կատալիզատոր, ճնշում և ջերմաստիճան
- :
Նիտրոֆոսֆատային մեթոդ խմբագրել
Այս մեթոդը ավելի հայտնի է, որպես Օդդի մեթոդ, ի պատիվ նորվեգական քաղաքի, որտեղ կատարվել է այդ պրոցեսը։ Այն օգտագործվում է ազոտային և ազոտաֆոսֆորային պարարտանյութերի ստացման համար[20][21][22]։
- Կալցիումի ֆոսֆատը լուծում են ջրում։
- .
- ստացված խառնուրդը սառեցնում են մինչև 0 °C, արդյունքում կալցիումի ֆոսֆատը բյուրեղանում է տետրահիդրատի ձևով — Ca(NO3)2·4H2O, և այն առանձնացնում են ֆոսֆորական թթվից։
- Ստացված կալցիումի նիտրատը և չհեռացված ֆոսֆորական թթուն փոխազդում են ամոնիակի հետ, արդյունքում ստացվում է ամոնիումի նիտրատ։
- :
Քիմիական հատկություններ խմբագրել
Քայքայման ռեակցիաներ խմբագրել
Ամոնիումի նիտրատի ջերմային քայքայումը կարող է ընթանալ տարբեր կերպ, կախված ջերմաստիճանից[23][24]։ Ջերմաստիճանը ցածր է 270
- .
- Ջերմաստրճանը բարձր է 270 °C-ից։
- .
Գրականություն խմբագրել
- Технология аммиачной селитры, под ред. В. М. Олевского, М., 1978.
- Соли азотной кислоты, Миниович М. А., М., 1964.
- Олевский В. М., Ферд М. Л., «Ж. Всес. хим. о-ва им. Д. И. Менделеева», 1983, т. 28, № 4, с. 27—39:
Ծանոթագրություններ խմբագրել
- ↑ 1,0 1,1 6484-52-2
- ↑ 2,0 2,1 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 3,0 3,1 3,2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 4—47. — ISBN 978-1-4987-5428-6
- ↑ 4,0 4,1 CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—4. — ISBN 978-1-4987-5428-6
- ↑ «Ammonium nitrate MSDS». Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 18-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim.
- ↑ «Nutrient Content of Fertilizer Materials» (PDF). Արխիվացված է օրիգինալից (PDF) 2012 թ․ դեկտեմբերի 24-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate United States Environmental Protection Agency
- ↑ [1](չաշխատող հղում)
- ↑ «Արխիվացված պատճենը». Արխիվացված է օրիգինալից 2011 թ․ նոյեմբերի 24-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ http://www.dallasnews.com/news/west-explosion/headlines/20130506-investigators-blame-ammonium-nitrate-in-massive-west-explosion.ece Investigators blame ammonium nitrate in massive West explosion
- ↑ Cook, Melvin A. (1974). The Science of Industrial Explosives. IRECO Chemicals. էջ 1. ASIN B0000EGDJT.
- ↑ Pothole pond
- ↑ Progressive Farmer Magazine
- ↑ Fertilizers Europe (2006). «Guidance for Compatibility of Fertilizer Blending Materials» (PDF). Արխիվացված է օրիգինալից (PDF) 2015 թ․ հունիսի 8-ին.
- ↑ Dangerous Goods (HCDG) Regulations
- ↑ https://www.google.com/patents/pdf/Process_of_producing_concentrated_soluti.pdf?id=XronAAAAEBAJ&output=pdf&sig=ACfU3U0iYFRDUxltKLaVind-3wwP_JYPxg
- ↑ Ammonium Nitrate-Regulating its use, Balancing Access & Protection from «Worksafe Victoria». Արխիվացված է օրիգինալից 2011 թ․ մարտի 11-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ Choi, C. S.; Prask, H. J. (1983). «The structure of ND4NO3 phase V by neutron powder diffraction». Acta Crystallographica B. 39 (4): 414–420. doi:10.1107/S0108768183002669.
- ↑ CF Industries. «Ammonium nitrate MSDS» (PDF). Արխիվացված է օրիգինալից (PDF) 2014 թ․ մարտի 27-ին.
- ↑ «Chemicalland21 – Ammonium Nitrate». Արխիվացված է օրիգինալից 2012 թ․ հունվարի 10-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ «Ammonium Nitrate». Paton Fertilizers Pty Ltd. 2005.
- ↑ «Material Safety Data Sheet, Ammonium nitrate MSDS». Արխիվացված է օրիգինալից 2011 թ․ օգոստոսի 18-ին. Վերցված է 2015 թ․ հուլիսի 7-ին.
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. ISBN 1-903996-65-1.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ամոնիումի նիտրատ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 326)։ |