Ամինաթթու
Ամինաթթուները երկֆունկցիոնալ միացություններ են, որոնց կազմի մեջ մտնում են մեկ կամ մի քանի ամինա և կարբօքսիլ խմբեր։ Ամինաթթուները ունեն կարևոր նշանակություն բոլոր կենսաբանական համակարգերի համար։ Նրանցից շատերն ունեն կարգավորիչ ֆունկցիա զանազան հյուսվածքներում։ Արոմատիկ ամինաթթուների ներկայացուցիչները (բենզոլի ածանցյալները) մտնում են մի շարք կյանքի համար անհրաժեշտ միացությունների կազմի մեջ և կիրառվում են որպես դեղանյութեր։ Օրինակ՝ պարաամինաբենզոաթթուն (ՊԱԲԹ) որոշ բակտերիաներ օգտագործում են տետրահիդրաֆոլաթթվի (վիտամին) սինթեզի համար։

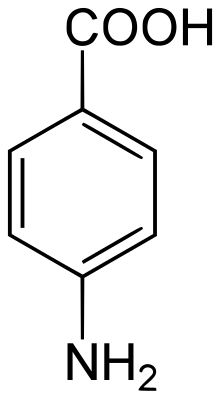
Սուլֆա-դեղանյութերը (սուլֆանիլամիդները) նման են ՊԱԲԹ-ին և գործում են շնորհիվ այդ նմանությանը։ Սուլֆանիլամիդների կիրառման պայմաններում մանրէները ՊԱԲԹ-ի փոխարեն սկսում են օգտագործել սուլֆամիացությունները և մահանում են ֆոլաթթվի անբավարարության զարգացման հետևանքով։ Որոշ արոմատիկ ամինաթթուների[1] էսթերներ առաջացնում են տեղային անզգայացում.այդ հատկությունը առավել արտահայտված է պարա-ածանցյալների մոտ։ Բժշկության մեջ լայն կիրառում ունեն անեսթեզինը (պ-ամինաբենզոաթթվի էթիլ էսթեր) և նովոկաինը (ՊԱԲԹ-ի դիէթիլամինաէթիլ էսթեր)[2]։


Ամինաթթուների առավել կարևոր դերն այն է, որ սպիտակուցները,որոնք կենդանի օրգանիզմներում, կատարում են բազմաթիվ ֆունկցիաներ (կարգավորիչ, կատալիտիկ, պաշտպանողական, տրանսպորտային, ռեցեպտոր, կառուցվածքային և այլն), կազմված են ամինաթթուներից։ Մի շարք անտիբիոտիկներ, հորմոններ և տոքսիններ նույնպես ունեն պեպտիդ-սպիտակուցային կառուցվածք։ Պեպտիդները և սպիտակուցները α-ամինաթթուներից կառուցված բարձրամոլեկուլյար միացություններ են։ Սպիտակուցների կազմի մեջ մտնող ամինաթթուները բոլորը Լ-շարքի α-ամինաթթուներ են, այսինքն ամին և կարբօքսիլ խմբերը գտնվում են նույն ածխածնի մոտ և ամինաթթուները տարբերվում են միայն ռադիկալների կառուցվածքով[3]։
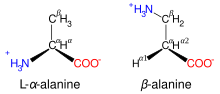
Այժմ գոյություն ունեն ամինաթթուների մի շարք դասակարգումներ՝ ըստ ածխածնաին շղթայի կառուցվածքի, ամինախմբի դիրքի, կարբօքսիլ- և ամինախմբերի քանակի, ստերեոիզոմերների, կենսաբանական դերի և այլն։ Օրինակ, ըստ ամինախմբի դիրքի տարբերում են α, β, γ և այլ ամինաթթուներ[4]։

ըստ կարբօքսիլ և ամինախմբերի քանակի՝ թթվային, հիմնային և չեզոք։



Ըստ կենսաբանական դերի ամինաթթուները բաժանվում են երկու խմբի՝ փոխարինելի և անփոխարինելի (ոչ էսենցիալ և էսենցիալ)։ Կենդանի օրգանիզմի ամինաթթվային պահանջը բավարարվում է երկու ճանապարհով.
- օրգանիզմում որոշ ամինաթթուներ սինթեզվում են համապատասխան կետոթթուներից (այդ պրոցեսը կոչվում է սինթեզ de novo),
- ամինաթթուները առաջանում են սննդամթերքի սպիտակուցների հիդրոլիզից։ Այն ամինաթթուները, որոնք կարող են սինթեզվել կենդանի օրգանիզմում, կոչվում են փոխարի նելի, մնացած ամինաթթուները կոչվում են անփոխարինելի և օրգանիզմում չեն սինթեզվում։ Անփոխարինելի ամինաթթուների խմբին են պատկանում վալինը, լեյցինը, իզոլեյցինը, տրեոնինը, մեթիոնինը, ֆենիլալանինը, տրիպտոֆանը։ Բնության մեջ հայտնաբերված մոտ 300 ամինաթթուներից միայն 20 (22) են մտնում սպիտակուցների կազմի մեջ։ Պինդ վիճակում և ջրային լուծույթներում չեզոքին մոտ pH-ի պայմաններում α-ամինաթթուները գտնվում են ներքին աղերի ձևով[5]։

Սպիտակուցների կազմի մեջ մտնող α-ամինաթթուները ջրում լավ լուծվող, բարձր հալման ջերմաստիճան ունեցող բյուրեղային նյութեր են։ Որոշ ներկայացուցիչները քաղցրահամ են (գլիցինը), մի մասը անհամ, իսկ, օրինակ L-գլուտամինաթթուն պայմանավորում է մսի յուրահատուկ համը։ Կարևոր նշանակություն ունի այն փաստը, որ բավականին հաճախ սպիտակուցների սինթեզը ավարտելուց հետո սպիտակուցի կազմում որոշ ամինաթթուներ ենթարկվում են մոդիֆիկացիայի։ Դրանով է պայմանավորված սպիտակուցների հիդրոլիզատներում քսանից ավելի ամինաթթուների առկայությունը[6]։
Ամինաթթուների ստերեոիզոմերիա խմբագրել
Քանի որ α-ածխածինը ասիմետրիկ է (խիրալ կենտրոն է), α-ամինաթթուները (գլիցինի բացառությամբ) գոյություն ունեն տարբեր կոնֆիգուրացիոն ստերեոիզոմերների ձևով՝ L և D α-ամինաթթուների ձևով։ α-ամինաթթուների, ինչպես և օքսիթթուների կոնֆիգուրացիան, որոշվում է կոնֆիգուրացիոն ստանդարտների օգնությամբ։ Ամինաթթուների բանաձը նույնպես ընդունված է գրել Ֆիշերի կառուցվածքային բանաձևերով։
Մի շարք ամինաթթուներ ունեն մեկից ավելի խիրալ կենտրոն. օրինակ իզոլեյցինը, տրեոնինը, 4-հիդրօքսիպրոլինը նույնպես ունեն երկու խիրալ կենտրոն և համապատասխանաբար չորս դիաստերեոմերներ։
Կենդական օրգանիզմներում սպիտակուցների կազմի մեջ մտնում են միայն L-շարքի ամինաթթուներ, մանրէների մոտ հանդիպում են նաև D-շարքի ներկայացուցիչներ։
Ամինաթթուների անվանակարգը խմբագրել
Ամինաթթուները անվանվում են համաձայն սիստեմատիկ անվանակարգի կանոնների, սակայն սովորաբար օգտագործում են ամինաթթուների կիրառական, այսպես կոչված, տրիվիալ կամ գործածական անունները և հապավումները։
Սպիտակուցների կազմի մեջ մտնող ամինաթթուների ռադիկալները և անվանակարգը։
Սպիտակուցի սինթեզին մասնակցող ամինաթթուների ժամանակակից դասակարգումը հիմնված է ամինաթթուների ռադիկալների հատկությունների վրա։ Ըստ ռադիկալների կառուցվածքային յուրահատկությունների սպիտակուցների կազմի մեջ մտնող ամինաթթուները բաժանվում են երկու հիմնական խմբերի՝ հիդրոֆիլ և հիդոֆոբ։ Հիդրոֆիլ ամինաթթուները իրենց հերթին բաժանվում են երկու խմբի՝ լիցքավորված (դրական և բացասական) և բևեռացված չլիցքավորված ամինաթթուների։ Դրական լիցքավորված ամինաթթուների խմբին են պատկանում արգինինը, լիզինը և հիստիդինը, բացասական լիցքավորվածների՝ ասպարագինաթթուն և գլուտամինաթթուն։ Բևեռացված չլիցքավորված ամինաթթուների խմբին են պատկանում սերինը, ցիստեինը, թիրոզինը, տրեոնինը, գլուտամինը, ասպարագինը։ Հիդրոֆոբ ամինաթթուներն են ալանինը, մեթիոնինը, վալինը, լեյցինը, իզոլեյցինը, տրիպտոֆանը, ֆենիլալանինը։
Սպիտակուցների հիդրոլիզատներում հաճախ հայտնաբերվում են մի շարք այլ ամինաթթուներ։ Դա պայմանավորված է նրանով, որ բավականին հաճախ սպիտակուցների սինթեզը ավարտելուց հետո սպիտակուցի կազմում որոշ ամինաթթուներ ենթարկվում են մոդիֆիկացիաների, առաջացնելով մի շարք նոր, տվյալ սպիտակուցների ֆունկցիաները կատարելու համար կարևոր ամինաթթուներ։ Օրինակ՝ կոլագեն սպիտակուցում պրոլինի հիդրօքսիլացման հետևանքով առաջանում է 4-հիդրօքսիպրոլին, բոլոր սպիտակուցների երրորդային կառուցվածքի ձևավորման ժամանակ ցիստեինի օքսիդացման շնորհիվ առաջանում է ցիստին, մակարդելիությանը մասնակից պրոտրոմբին սպիտակուցի կազմում գլուտամինաթթուն ենթակվումէ կարբօքսիլացման γ-կարբօքսիգլուտամինաթթվի առաջացումով և այլն։
Ամինաթթուների թթվահիմնային հատկությունները խմբագրել
Ջրային լուծույթներում ամինաթթուները գտնվում են բիպոլյար, կատիոնային և անիոնային ձևերի հավասարակշիռ խառնուրդի ձևով։ Հավասարակշիռ վիճակը կախված է միջավայրի pH-ից։
NH3+-CH(R)-COOH(Կատիոնային ձև)+H+→NH3+-CH(R)-COO-(Երկբևեռ իոն)→NH2-CH(R)-COO-(Անիոնային ձև)
Լրիվ պրոտոնացված α-ամինաթթուն (կատիոնային ձևը) ըստ Բրենստեդի, երկհիմն թթու է, ենթարկվում է աստիճանական դիսոցման և ունի դիսոցման հաստատունի երկու արժեք՝ pKa1 և pKa2։pKa1, որի մեծությունը տատանվում է 1-3 սահմաններում, բնութագրում է կարբօքսիլ խմբի թթվային հատկություններ։ pKa2 բնութագրում է ամոնիումային խմբի թթվայնությունը և գտնվում է 9-ից մինչև 10 տիրույթում։
pH-ի այն արժեքը, որի դեպքում բիպոլյար իոնների կոնցենտրացիան առավելագույնն է, իսկ կատիոնային և անիոնային ձևերի մինիմալ կոնցենտրացիաները հավասարվում են, կոչվում են իզոէլեկտրիկ կետ (pl)։
pl=1/2(pKa1+pKa2)
Իզոէլեկտրիկ կետում α-ամինաթթուների մոլեկուլների գումարային լիցքը հավասար է զրոյի։ Բիպոլյար իոնները չեն տեղաշարժվում էլեկտրական դաշտում։ Եթե միջավայրի pH-ը ցածր է ամինաթթվի pl-ից, ամինաթթուն գտնվում է կատիոնային ձևով և շարժվում է դեպի կատոդ, եթե բարձր է՝ ապա անիոնային ձևով և շարժվում է դեպի անոդ։ Այս հատկության վրա է հիմնված ամինաթթուների բաժանումը էլեկտրաֆորեզի եղանակով։
Ամինաթթուների առաջացման եղանակները խմբագրել
Օրգանիզմում ամինաթթուները հիմնականում առաջանում են պեպտիդների և սպիտակուցների հիդրոլիզի արդյունքում։ Սպիտակուցների մարսողությունը աղեստամոքսային տրակտում և քայքայումը հյուսվածքներում կատարվում են մի շարք ֆերմենտների (պեպսին, տրիպսին, խիմոտրիպսին, կատեպսիններ և այլն) մասնակցությամբ։
Հիդրոլիզի կարող է կատարվել ինչպես ֆերմենտների, այնպես էլ թթուների և հիմքերի ազդեցության պայմաններում։ Լաբորատոր պայմաններում լայն կիրառում ունի թթվային հիդրոլիզը։
H2N-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-COOH -→H2N-CH-CO-OH+H2N-CH-CO-OH+....
.........I...................I...................I...................I.............................I............................I
.......(R1).............(R2)..............(R3).............(R4)........................(R1).....................(R2)
Ամինաթթուների կենսասինթեզը կետոթթուներից ընթանում է երկու հիմնական եղանակներով՝
ա)տրանսամինացման, որը հիմնական բիոսինթետիկ ուղին է։ Տրանսամինացման ընթացքում կետոթթուն (α-կետոգլուտարաթթուն) ընդունում է ամինախումբ որևէ ամինաթթվից, վերածվելով համապատասխան ամինաթթվի։
Պրոցեսը կատարվում է տրանսամինազ ֆերմենտների մասնակցությամբ։ Որպես կոնֆերմենտ մասնակցում է պիրիդօքսալֆոսֆատը։
Այս պրոցեսում պիրիդօքսալֆոսֆատը ծառայում է որպես ամինախմբի պահեստարան, որպեսզի հետագայում փոխանցի այն որևէ կետոթթվի։ Ռեակցիան ընթանում է երկու փուլով։ Առաջին փուլում տեղի է ունենում որևէ ամինաթթվի փոխազդեցություն ֆերմենտի հետ և ամինախմբի տեղափոխում կոնֆերմենտի վրա։
Երկրորդ փուլում պիրիդօքսալֆոսֆատը փոխազդում է որևէ կետոթթվի հետ, փոխանցելով ամինախումբը նրա վրա։
Փաստորեն տեղի է ունենում վերամինացում, կամ երկու ֆունկցիոնալ խմբերի՝ կետոթթվի կարբոնիլ և ամինաթթվի ամինախմբի փոխանակում։
բ)չհագեցած թթվի և ամիոնիակի փոխազդեցության արդյունքում (β-ամինաթթուների առաջացնում α,β-չհագեցած կարբոնաթթուներից)։
R-CH=CH-COOH+NH3→R-CH(NH2)-CH2-COOH
գ)α-կետոթթուների վերականգնիչ ամինացում, որը կատարվում է ֆերմենտատիվ եղանակով, որպես կոնֆերմենտ հանդես է գալիս NADH+H+։
HOOC-CH2-CH2-CO-COOH→HOOC-CH2-CH2-CH(NH2)-COOH
2.Կարբոնաթթուներից հալոգենացման և հետագա ամոնոլիզի ճանապարհով։
R-CH(Br)-COOH+NH3→R-CH(NH2)-COOH
3.Ցիանհիդրինային սինթեզի եղանակով։
Ամինաթթուների քիմիական հատկությունները խմբագրել
Ամինաթթուներին բնորոշ են բոլոր այն քիմիական հատկությունները, որոնք պայմանավորված են ամինա և կարբօքսիլ խմբերով։ Շնորհիվ իրենց կազմի մեջ մտնող ամինա- և կարբօքսիլ խմբերի ամինաթթուները հանդիսանում են ամֆոտեր միացություններ, հետևաբար, առաջացնում են աղեր և՜ թթուների, և՜ հիմքերի հետ փոխազդելիս։
α-հետերոֆունկցիոնալ միացությունները, այդ թվում և ամինաթթուները հակված են խելատային կոմպլեքս միացությունների առաջացման և մեղմ պայմաններում առաջացնում են լավ բյուրեղացվող պղնձի՝ Cu(II) ներկոմպլեքսային աղեր։ Դա պայմանավորված է երկու գործոններով՝ ա)կայուն հինգ և վեց անդամանի ցիկլերի առաջացման ձգտումով և բ)ֆունկցիոնալ խմբերի փոխադարձ ազդեցության շնորհիվ յուրաքանչյուր խմբի ռեակցիոնունակության բարձրացումով։
Սպիրտների հետ փոխազդելիս ամինաթթուները առաջացնում են բարդ էսթերներ, որոնք, ի տարբերություն ամինաթթուների, չունեն երկբևեռ կառուցվածք։ Ամինաթթուների էսթերները լուծվում են օրգանական լուծիչներում, ցնդող են և այդ հատկության վրա է հիմնված ամինաթթուների բաժանման (առաջին անգամ առաջարկվել է Ֆիշերի կողմից 1901 թ) էսթերային եղանակը։ Ժամանակակից գազհեղուկային քրոմատոգրաֆիկ եղանակները նույնպես հիմնված են այդ հատկության վրա։
1.Ամինաթթուների կարևորագույն հատկություններից է պեպտիդների առաջացումը։
2.միջմոլեկուլային դեհիդրատացում α-ամինաթթուների միջև, ցիկլիկ դիպեպտիդների (դիկետոպիպերազինների) առաջացումով։
3.Ամինաթթուների դեզամինացման եղանակները զանազան են և պայմանավորված են կենսաբանական համակարգերում գործող ֆերմենտների բնույթով։ Մանրէների մոտ կատարվում է β-ամինաթթուների ներմոլեկուլային դեզամինացում։ Կարևոր նշանակություն ունի ասպարագինաթթվի դեզամինացումը, որը կատարվում է այս մեխանիզմով ասպարտազ ֆերմենտի ազդեցությամբ ֆումարաթթվի առաջացումով։
R-CH(NH2)-CH2-COOH→R-CH=CH-COOH+NH3
HOOC-CH2-CH(NH2)-COOH→HO2CCH=CHCO2H+NH3
բ)Կաթնասունների մոտ ամոնիակը հիմնականում առաջանում է ամինաթթուների օքսիդացնող դեզամինացման ճանապարհով։ Հյուսվածքների ֆիզիոլոգիական pH-ի պայմաններում առավել ակտիվ է ընթանում գլուտամինաթթվի ֆերմենտային դեզամինացումը գլուտամատդեհիդրոգենազ ֆերմենտի մասնակցությամբ։ Ռեակցիայի առաջին փուլում օքսիդացման հետևանքով առաջանում է իմինաթթու, որը ինքնաբերաբար ենթարկվում է հիդրոլիզի, անջատելով ամոնիակ և վերածվելով կետոթթվի։
HOOC-CH2-CH2-CH(NH2)-COOH→HOOC-CH2-CH2-CO-COOH
գ.հիդրօքսի խումբ պարունակող ամինաթթուները ենթարկվում են դեհիդրատացնող դեզամինացման (էլիմինացում-հիդրատացում),կետոթթուների առաջացումով։
CH3-CH(OH)-CH(NH2)-COOH→H3C-CH=C(NH2)-COOH→H3C-CH2-C(=NH)-COOH→H3C-CH2-CO-COOH
Նման եղանակով է կատարվում ցիստեինի դեսուլֆհիդրինային դեզամինացումը։
4.Ամինաթթուներ դեկարբօքսիլացումը լաբորատոր պայմաններում,in vitro,կատարվում է բարձր ջերմաստիճանում Ba(OH)2 ներկայությամբ ամինների առաջացումով։ Կենդանի օրգանիզմներում դեկարբօքսիլացումը ընթանում է դեկարբօքսիլազ ֆերմենտների մասնակցությամբ և արդյունքում առաջանում են բիոգեն ամիններ։
5.Ալդոլային ճեղքման եղանակով սերինից և տրեոնինից կարող է առաջանալ գլիցին։
H2C(OH)-CH(NH2)-COOH→H2C(NH2)-COOH+HCHO
6.γ և δ-ամինաթթուների ներմոլեկուլային դեհիդրատացման արդյունքում առաջանում են ցիկլիկ ամիդներ, լակտամներ։
Ամինաթթուների հայտնաբերման որակական ռեակցիաներ խմբագրել
α-Ամինաթթուների հայտնաբերման ընդհանուր, (ունիվերսալ) ռեակցա է նինհիդրինային ռեակցիան, որի արդյունքում առաջանում է կապտամանուշակագույն միացություն։
Ունիվերսալ ռեակցիաների խմբին է պատկանում նաև բիուրետային ռեակցիան, որը տալիս են մեկից ավելի պեպտիդային կապ ունեցող միացություններ։ Հիմնային միջավայրում երկարժեք պղնձի (II) իոնները պեպտիդային կապի հետ փոխազդելով, առաջացնում են կապտամանուշակագույն կոմպլեքսներ։ Ռեակցիան կոչվում է բիուրետային, քանի որ բիուրետը նույնպես տալիս է այս ռեակցիան։ Գոյություն ունեն նաև ամինաթթուների հայտնաբերման մի շարք յուրահատուկ (սպեցիֆիկ), առանձին ամինաթթուների համար բնորոշ ռեակցաներ։ Օրինակ, քսանտոպրոտեինային ռեակցիան, որի օգնությամբ հայտնաբերվում են արոմատիկ ցիկլեր պարունակող ամինաթթուները՝ խիտ ազոտական թթվով թիրոզինի վրա ազդելիս առաջանում է դեղին գունավորում ունեցող նիտրոմիացություն։
Հիմք ավելացնելիս դեղին գույնը փոխվում է նարնջագույնի՝ կապված ֆենոլային հիդրօքսիլ խմբի իոնացման հետ (անիոնի մասնակցությունը զուգորդմանը ավելի մեծ է)։ Սպեցիֆիկ հայտնաբերման ռեակցիաների խմբին են պատկանում ծծումբ (SH-խումբ) պարունակող ամինաթթուների հայտնաբերման Ֆոլի ռեակցիան (ցիստեին),որի արդյունքում առաջանում է կապարի սուլֆիդի սև գույնի նստվածք։
CH2(SH)-CH(NH2)-COOH+2NaOH→CH2(OH)-CH(NH2)-COOH+Na2S+H2O
(CH3COO)2Pb+2NaOH→Pb(ONa)2+2CH3COOH
Na2S+Pb(ONa)2→PbS↓+4NaOH
Ամինաթթուների քանակական որոշման եղանակներ խմբագրել
Հաճախ անհրաժեշտ է լինում հետազոտվող լուծույթներում որոշել ամինաթթուների քանակը։ Գոյություն ունեն մի շարք եղանակներ, որոնցից ավելի կիրառելի էին Վան-Սլայկի և Սերենսենի եղանակները։
1.Առաջին էությունն այն է, որ ազոտային թթվով ազդելիս ամինաթթուներից անջատվում է գազային ազոտ, որի ծավալը չափերով կարելի է որոշել ամինաթթուների կոնցենտրացիան լուծույթում (Վան-Սլայկի եղանակ)։
R-CH(NH2)-COOH+HNO2→R-CH(OH)-COOH+N2↑+H2O
2.Սերենսենի կամ ֆորմոլ տիտրման եղանակ՝ ամինաթթուները ալդեհիդների հետ փոխազդելիս առաջացնում են տեղակալված իմիններ (ամինախումբը կապվում է),և հնարավոր է դառնում ազատ կարբօքսիլ խմբերը տիտրել հիմքով։
- RCH(NH2)COOH + HCHO + KOH → RCH(NHCH2OH)COOK + H2O
Պեպտիդներ, սպիտակուցներ խմբագրել
Պեպտիդները և սպիտակուցները բիպոլիմերներ են, որոնց մոնոմերներ են հանդիսանում ամինաթթուները։ Պայմանականորեն ընդունված է մինչև 50-100 ամինաթթվային մնացորդ ունեցող շղթան անվանել պեպտիդ, ավելի մեծ թվով ամինաթթուների դեպքում՝ սպիտակուց։ Պոլիպեպտիդները իրենց հերթին բաժանում են օլիգոպեպտիդների (մինչև 10 ամինոթթվային մնացորդ) և պոլիպեպտիդների։ Պեպտիդները և սպիտակուցները բնական կամ արհեստական ծագում ունեցող նյութեր են, որոնցում ամինաթթուները կախված են միմյանց հետ պեպտիդային կապով։
Սպիտակուցներում և պեպտիդներում ազատ ամինախումբ կրող ծայրը անվանվում է N-ծայրային և համարվում շղթայի սկիզբը (ձախ ծայրը), ազատ կարբօքսիլ խումբ կրող ծայրը անվանվում է C-ծայրային և համարվում է շղթայի վերջը (աջ ծայրը)։ Պեպտիդների անվանումը սկսվում է N-ծայրից։ Բոլոր ամինաթթվային մնացորդների, բացի C-ծայրային ամինաթթվից, անվան «-ին» վերջավորությունը փոխվում է «-իլ»-ով, օրինակ ալանին, ֆենիլալանին և հիստիդին ամինաթթուներից կազմված պեպտիդը կանվանվի ալանիլֆենիլալանիլհիստիդին։
Օրինակ երեք ամինաթթվային մնացորդից կարելի է կազմել 6 տարբեր պեպտիդ, իսկ ութ ամինաթթուներից կազմված հնարավոր պեպտիդների թիվը հասնում է 40000։ Ամինաթթուների հաջորդականությունը պեպտիդներում և սպիտակուցներում ապահովում է այդ միացությունների յուրահատկությունները և ապացուցում սերտ կապը կառուցվածքի և ֆունկցիայի միջև։ Օրինակ, ասպարտամի (ասպարտիլֆենիլալանինի մեթիլ էսթեր) յուրահատուկ կառուցվածքով է (կազմված է Լ-ամինաթթուներից) պայմանավորված նրա բացառիկ քաղցր համը։
Այլ ստերեոքիմիական շարքի պատկանող ամինաթթուների ցանկացած համադրության դեպքում ստացվում են շատ ավելի անհամ միացություններ։ Նույն ամինաթթուներից կազմված տարբեր հաջորդականություն ունեցող միացությունների հատկությունները զգալիորեն տարբերվում են։ Բայց, սովորաբար, այդ բազմությունից միայն մեկ տարբերակն է դրսևորում բարձր կենսաբանական ակտիվություն։ Սպիտակուցների և պեպտիդների առաջնային կառուցվածքը պայմանավորված է ամինաթթվային հաջորդականությամբ, որը կարելի է որոշել շղթայի որևէ ծայրից ամինաթթուները հաջորդաբար անջատելով։
Սպիտակուցների և պեպտիդների առաջնային կառուցվածքի որոշման եղանակները խմբագրել
Սպիտակուցների և պեպտիդների առաջնային կառուցվածքի որոշման առաջին եղանակներից մեկը Սենջերի կողմից մշակված պեպտիդային շղթայի N-ծայրային ամինաթթվի որոշման եղանակն է։ Առաջին փուլում պոլիպեպտիդային շղթան (սպիտակուցը) փոխազդում է դինիտրոֆտորբենզոլի (ԴՆՖԲ) հետ, անջատվում է HF և դինիտրոբենզոլը (ԴՆԲ) միանում է շղթայի N-ծայրային ամինաթթվին։ Երկրորդ փուլում անց է կացվում հիդրոլիզ, առաջանում է ամինաթթուների խառնուրդ, որում միայն N-ծայրային ամինաթթուն է հանդիսանում ԴՆԲ-ածանցյալ։ Երրորդ փուլում կատարվում է նշակիր ամինաթթվի ԴՆԲ-ածանցյալի իդենտիֆիկացում։
Երկրորդ եղանակը՝ Էդմանի եղանակն է, որն ավելի լայն կիրառում ունի, քանի որ ավելի շահավետ է և ռացիոնալ։ Այս մեթոդում որպես «նիշ» օգտագործվում է ֆենիլիզոթիոցիանատը։ Փուլերի հաջորդականությունը համարյա նույնն է՝ նիշի միացում (1),որի հետևանքով առաջանում է N-ծայրային ամինաթթվի ֆենիլթիոգիդանտոինային (ՖԹԳ) ածանցյալ, ամինաթթվի ածանցյալ անջատում (2) և իդենտիֆիկացում (3)։
Առաջնային կառուցվածքի որոշման համար կիրառվում են նաև բազմաթիվ այլ եղանակներ, որոնց էությունը նույնն է։ Պեպտիդային կապը իրենից ներկայացնում է եռկենտրոն զուգորդված համակարգ, որում C-N կապերի շուրջ պտույտ չի կատարվում։ Սպիտակուցների համար հայտնի են ավելի բարդ կառուցվածքներ՝ երկրորդային կառուցվածք՝ α-պարույր կամ β-կառուցվածք (ծալքավոր կառուցվածք),երրորդային կառուցվածք, չորրորդային կառուցվածք։
α-պարույրի յուրաքանչյուր պտույտ՝ «փոքր քայլ»,պարունակում է միջին թվով 3,6 ամինաթթվային մնացորդ, որոնք ջրածնական կապերով կապված են վեր և վար գտնվող պեպտիդային շղթայի հատվածների հետ։α-պարույրի մեծ քայլը կազմված է հինգ «փոքր քայլերից»,կամ 18 ամինաթթվային մնացորդից։
β-կառուցվածքը լինում է զուգահեռ և հակազուգահեռ։ Այդ կառուցվածքը առաջանում է սպիտակուցը կազմող տարբեր (հարևան) շղթաների միջև ջրածնական կապերի շնորհիվ, և բնորոշ է ֆիբրիլյար սպիտակուցներին։
Սպիտակուցների կենսաբանական ակտիվությունը պայմանավորված է նրանց երրորդային և չորրոդային կառուցվածքով։
Երրոդային կառուցվածքը ավելի բարդ է՝ դա α-շղթայի կամ β-ստրուկտուրայի տարածական դասավորվածությունն է։ Հիմնականում տարբերում են կծիկաձև (գլոբուլյար) և թելաձև (ֆիբրիլյար) երրորդային կառուցվածք։ Երրորդային կառուցվածքի ձևավորմանը մասնակցում են կովալենտ դիսուլֆիդային կապը (ցիստին ամինաթթուների միջև՝ օքսիդացման հետևանքով) և չորս տիպի ոչ կովալենտ փոխազդեցություններ։
Դիսուլֆիդային կապեր («կամրջակներ») կարող են առաջանալ ինչպես նույն սպիտակուցի տարբեր հատվածներում գտնվող ցիստեինների միջև, այնպեսլ էլ տարբեր պոլիպեպտիդային շղթաների միջև։ Օրինակ, ինսուլինում, գլյուկոզի փոխանակությունը կարգավորող սպիտակուցային բնույթի հորմոնևոմ, երեք դիսուլֆիդային կապերից երկուսը կապում են միմյանց հետ A (21 ամինաթթվային մնացորդ) և B (30 ամինաթթվային մնացորդ) շղթաները, իսկ երրորդը առաջանում է A շղթայի վեցերորդ և տասնմեկերորդ դիրքերում գտվող ցիստեինների միջև։
Սպիտակուցների երրորդային կառուցվածքի ձևավորմանը մասնակից ոչ կովալենտ կապերը խմբագրել
Երրորդային կառուցվածքի ձևավորման ժամանակ, երկրորդային կառուցվածքի նմանությամբ, առաջանում են ջրածնական կապեր առաջնային կառուցվածքի -NH և -C=O խմբերի միջև։ Ջրածնական կապեր են առաջանում նաև այն ամինաթթուների միջև, որոնց ռադիկալներում կան բևեռացված, ոչ իոնացված ֆունկցիոնալ խմբեր։
Ռադիկալներում կարբօքսիլ և ամինախումբ պարունակող ամինաթթուները ֆիզիոլոգիական պայմաններում իոնացված են, կրում են համապատասխան բացասական և դրական լիցք, որի հետևանքով, երբ նման ամինաթթուների զույգերը հայտնվում են բավականին մոտ դիրքերում (տարածական),նրանց միջև առաջանում է իոնական կապ (աղային կամրջակ)։
Ամինաթթուների ոչ բևեռային (հիդրոֆոբ) ռադիկալները միավորվում են հիդրոֆոբ փոխազդեցությունների շնորհիվ (նման յուղի մոլեկուլների փոխազդեցությունները ջրի մակերեսին)։ Ջրի մոլեկուլների միջմոլեկուլային փոխազդեցությունները այնքան ուժեղ են, որ հիդրոֆոբ խմբերը չեն կարող ներխուժել նրանց միջև և առաջացնում են «գրպանիկ»։
Սպիտակուցների չորրորդային կառուցվածքն առաջանում է, երբ երկու և ավելի սպիտակուցային շղթաներ միավորված են միմյանց հետ կովալենտ կամ ոչ կովալնետ փոխազդեցություններով և միայն այդ դեպքում կարող են կատարել իրենց ֆունկցիան։ Սպիտակուցների կենսաբանական ակտիվությունը, այսպես կոչված նատիվ հատկությունները, պայմանավորված են երրորդային և չորրդային կառուցվածքներով։ Բոլոր գործոնները, որոնք խախտում են երրորդային և չորրորդային կառուցվածքներով։ Բոլոր գործոնները, որոնք խախտում են երրորդային և չորրորդային կառուցվածք բերում են բնափոխման։ Բարձր ջերմաստիճանի, ֆիզիկական այլ գործոնների, դետերգենտների, օրգանական լուծիչների,pH-ի փոփոխության, անօրգանական աղերի ազդեցության դեպքում սպիտակուցները ենթարկվում են բնափոխման (դենատուրացիայի)։
Տես նաև խմբագրել
Ծանոթագրություններ խմբագրել
- ↑ Vauquelin LN, Robiquet PJ (1806). «The discovery of a new plant principle in Asparagus sativus». Annales de Chimie. 57: 88–93.
- ↑ «alpha-amino acid - Medical definition». Merriam-Webster dictionary.
- ↑ «Nomenclature and Symbolism for Amino Acids and Peptides». IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Արխիվացված է օրիգինալից 2008 թ․ հոկտեմբերի 9-ին. Վերցված է 2008 թ․ նոյեմբերի 17-ին.
- ↑ Manfred T. Reetz: Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future, J. Am. Chem. Soc. 135 (2013) S. 12480−12496.
- ↑ Smith, Anthony D. (1997). Oxford dictionary of biochemistry and molecular biology. Oxford: Oxford University Press. էջ 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ↑ Simmons, William J.; Gerhard Meisenberg (2006). Principles of medical biochemistry. Mosby Elsevier. էջ 19. ISBN 0-323-02942-6.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)
Գրականություն խմբագրել
- Michel Fleck, Aram Petrosyan, Salts of Amino Acids: Crystallization, Structure and Properties, «Springer», 2014 — 574 էջ, ISBN 978-3-319-06298-3։
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 1, էջ 318)։ |
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ամինաթթու» հոդվածին։ |